为什么没有质量文化就不可能实现数据完整性
近年来,关于数据完整性已经有了相当多的文章,嵌入式的、有效的质量文化仍然是一个 充分实现强大数据完整性的关键成功因素。在最近发表关于数据完整性的指导下,FDA(2018)甚至是直接陈述“这是管理层与执行责任创造质量文化的角色,其中员工了解数据完整性是组织核心价值鼓励员工识别和及时报告数据完整性问题。“The guidance document by its own admission “contains nonbinding recommendations” and states that “the use of the word ‘should’ in Agency guidances means that something is suggested or recommended, but not required,” yet the FDA makes explicit statements regarding “the role of management with executive responsibility to create a quality culture.” This would suggest (and inspection results confirm) that the FDA takes the relationship between quality culture and data integrity very seriously.
充分实现强大数据完整性的关键成功因素。在最近发表关于数据完整性的指导下,FDA(2018)甚至是直接陈述“这是管理层与执行责任创造质量文化的角色,其中员工了解数据完整性是组织核心价值鼓励员工识别和及时报告数据完整性问题。“The guidance document by its own admission “contains nonbinding recommendations” and states that “the use of the word ‘should’ in Agency guidances means that something is suggested or recommended, but not required,” yet the FDA makes explicit statements regarding “the role of management with executive responsibility to create a quality culture.” This would suggest (and inspection results confirm) that the FDA takes the relationship between quality culture and data integrity very seriously.
肠外药物协会(PDA)制药行业数据完整性的行为准则的要素“旨在加强制药行业质量和信任的文化。”行为准则进一步表明,支持代码,“公司将建立以下计划:(1)促进鼓励道德编码的组织文化;(2)展示本公司承诺遵守适用法律;(3)要求预防和检测数据完整性失误。“
为了成功地建立和持续质量文化,Uydess和Meyers(2011)恰当地指出:“心态和行为……必须从高层开始,并被公司各阶层和各职能部门的员工所效仿。”我们发现,当企业文化的主题从高层管理者那里被清晰地表达出来,并在组织的所有级别中得到加强时,就会对数据完整性的成熟度和质量实践的成熟度产生非常重要的积极影响。我们看到客户在没有483个观察结果的情况下进行了非常成功的检查,并得到了检查员非常积极的赞扬。相反,我们看到了质量文化的彻底失败,导致非常基本的和可预防的483个观察和警告信。
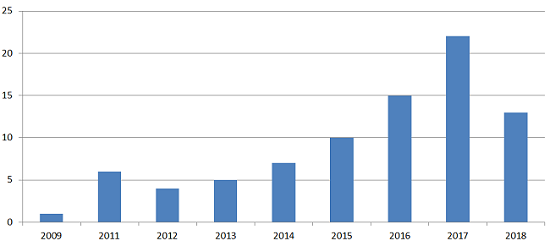
数字1:至少有483个观察特别引用数据完整性问题的美国FDA检查次数。
质量文化成熟度的滞后指标是重复观察/违反基本CGMP规范,这通常是未能充分调查、识别和解决根本原因的结果。至少在一个例子中,美国食品药品监督管理局在给一家动物保健公司的警告信中明确指出,该公司在密苏里州圣路易斯附近的设施中存在“质量实践和质量文化”问题,这是反复观察和多次违规的结果。2014年第四季度的检查共产生483个观察结果,在连续未能解决重复违规问题后,2015年12月发出了警告信。警告信中提到的重大偏差表明质量实践和质量文化非常不成熟,包括但不限于:
- 没有建立一个能够满足CGMP职责的质量控制部门并配备足够的人员。
- 未能防止未能符合规格的动物药品释放。
- 未能进行调查并解决所有差异/失败/偏差和投诉。
- 未能将失效调查扩展到其他可能受影响的产品或工艺。
- 没有使用变更控制程序来更新设备、程序或书面程序、作业指导书和表格。
- 未能确保对已批准的申请所作的更改已提交给适当的管理机构。
这些是基本的质量问题,导致了消费者对掺假产品的担忧,并对公司产生了直接的实质性影响。虽然在动物健康公司的警告信中并没有直接引用数据完整性,但所发现的问题与不成熟的质量文化是一致的,这与FDA提出非常具体的建议的数据完整性问题相关。
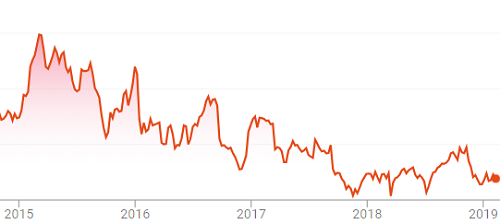
数字2:2015 - 2019年动物健康公司收到FDA警告信的股价
自此之后,这家动物保健公司在经营上取得了重大改进,解除了同意令,现在人们普遍认为该公司正在朝着更好的财务业绩迈进。
在最近的数据完整性指南中,FDA为解决数据完整性问题提出了具体的建议,坦率地说,这些建议适用于表明质量文化成熟度的水平。换句话说,度量这些活动可以同时指示质量文化成熟度的滞后指标和领先指标。
- 调查“确定问题的范围和根本原因。”
- 进行“科学健全的风险评估其潜在影响(包括对用于支持FDA提交的数据的影响)。”
- 实施“管理战略,包括解决根本原因的全球纠正措施计划。”
我们发现有效的应用这些建议的方法包括强大的质量系统和常规CGMP培训,但我们还发现数据完整性培训只是常规CGMP培训的组成部分。FDA(2018)建议培训预防和检测数据完整性问题是例行CGMP培训计划的一部分,并将其添加到所有员工所需的例行CGMP培训是一种非常有效的方法,确保所有级别的方法本组织了解数据完整性的承诺和责任。
When prevention is not achieved and data integrity issues are identified, it is also an indication of quality culture maturity to see how the issue is addressed both within the documented CGMP quality system (e.g., field alerts or biological product deviation reports) and through real-time direct feedback (e.g., elevating it to internal supervisors and external authorities without repercussion). In addition to quality system processes and internal management notification, data integrity issues may be sent to the FDA by emailingDrugInfo@fda.hhs.gov与主题行包含“CGMP数据完整性”。
管理人员要对质量文化负责,这将对数据完整性产生积极或消极的影响。通过评估质量文化成熟度并制定有目的的改进计划,公司可以实现对其组织、产品质量和业务价值的变革性影响。
引用:
食品及药物管理局(2018),数据完整性和符合药品CGMP:行业问题和答案指南(美国FDA, 2018年12月)。
- (2011)。发展及维持品质文化。BioPharm国际,24(11)。
关于作者:
 Kip Wolf是Tunnell Consulting的校长,在那里他带来了数据完整性实践。狼拥有超过25年的管理顾问的经验,在此期间,他还暂时在世界上一些顶级生命科学公司举行了各种领导职位。狼暂时工作在Wyeth Pre-Pfizer合并和Inside Merck后Schering合并中。在两种情况下,他领导了业务流程管理(BPM)组 - 在Wyeth的制造部门和默克的研发部门。在Tunnell,他使用他的产品开发计划管理经验,以提高成功监管备案和产品发布的可能性。他还咨询了,教导,发言和发布了数据完整性和质量系统的主题。可以达到狼kip.wolf@tunnellconsulting.com。
Kip Wolf是Tunnell Consulting的校长,在那里他带来了数据完整性实践。狼拥有超过25年的管理顾问的经验,在此期间,他还暂时在世界上一些顶级生命科学公司举行了各种领导职位。狼暂时工作在Wyeth Pre-Pfizer合并和Inside Merck后Schering合并中。在两种情况下,他领导了业务流程管理(BPM)组 - 在Wyeth的制造部门和默克的研发部门。在Tunnell,他使用他的产品开发计划管理经验,以提高成功监管备案和产品发布的可能性。他还咨询了,教导,发言和发布了数据完整性和质量系统的主题。可以达到狼kip.wolf@tunnellconsulting.com。

