实施欧盟耐多药和IVDR:经验教训,第一部分
通过马塞洛Trevino, Agendia
欧盟医疗器械法规(MDR)和体外诊断法规(IVDR)的转型并非易事 事业。由于质量体系和业务流程需要作出许多改变以满足新的法规,一些组织在实施和向其公告机构证明遵守方面面临挑战。首先,组织需要确保他们的设备具有准确的证书范围,并且当前的证书可以维护到过期。需要完善的计划和重要的监督的几个重要方面包括新的质量管理体系(QMS)和技术文件要求。
事业。由于质量体系和业务流程需要作出许多改变以满足新的法规,一些组织在实施和向其公告机构证明遵守方面面临挑战。首先,组织需要确保他们的设备具有准确的证书范围,并且当前的证书可以维护到过期。需要完善的计划和重要的监督的几个重要方面包括新的质量管理体系(QMS)和技术文件要求。
本文是由两部分组成的系列文章的第一篇。本文重点介绍了在欧盟MDR和欧盟IVDR实施过程中需要密切关注的经济经营者责任、总体质量管理考虑以及常见挑战,以确保平稳过渡并避免实施过程中的陷阱。的第二篇文章将重点介绍通报机构在技术文件评估过程中遇到的典型挑战。
经济经营者在整个供应链中的责任
各经济经营者的问责制显著提高,总结如下:
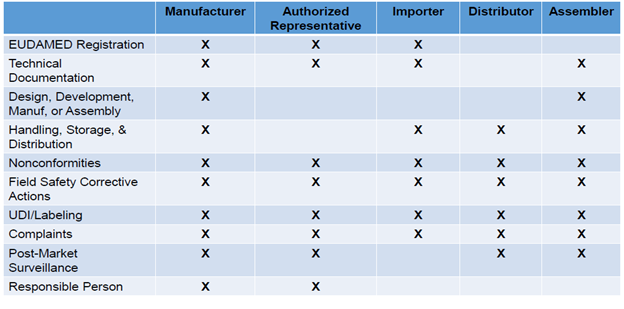
与经济操作员(类型)、联系细节和基本的唯一设备标识符(uddi - di)信息(风险等级、公告主体信息)相关的信息必须得到很好的定义。EU MDR和EU IVDR需要为设备分配一个基本的uddi - di,并将其与其他核心元素一起提供给UDI数据库。此外,制造商需要在欧洲医疗设备数据库(EUDAMED)中验证信息的准确性和最新性。
新法规要求欧盟委员会管理一个电子系统,创建一个单一的注册号码(SRN),用以识别制造商、授权代表和进口商。会员国维持在其领土内提供的装置分销商的登记。进口商须核实制造商或授权代表是否已向电子系统提供所需资料,并将任何不符之处通知授权代表或制造商。srn从主管当局获得,用于向公告机构申请符合性评估和访问EUDAMED。公众可查阅数据,主管当局可根据数据确定所需费用。数据必须定期更新,并验证其准确性,以符合规定。
同样重要的是要记住,初始审计必须至少部分在现场进行。由于当前的COVID-19限制措施,这变得具有挑战性;然而,制造商需要启动应急计划,并与其公告机构正式达成协议,以应对这种情况。千年发展目标2020-4为解决这一时限因素提供了指导方针;读我的文章在这里来讨论这个话题。
需要仔细审查和考虑的质量管理体系要求
新的文件和记录保存要求:许多现有的程序需要更新,从质量手册开始,它必须参考新的法规、新的通用规范和标准。如果预期用途需要调整,医疗设备文件和其他文件也需要更新。还应评估所有设备的新的记录保留要求。
根据欧盟第十条耐多药和欧盟IVDR,制造商应当保持技术文档,欧盟符合性声明,和,如果适用,相关证书的副本,包括任何修改和补充,按照发行第五十六条耐多药和第五十一条IVDR -在欧盟符合性声明涵盖的最后一个设备投放市场后至少10年,可向主管当局提供。
合规负责人:制造商和授权代表在其组织内应至少有一名负责合规的人员,该人员应在医疗设备或体外诊断设备(如适用)领域具备必要的专业知识。具体的专业知识和资格要求见欧盟MDR第15条和欧盟IVDR第15条。
法规遵从性策略:法规遵从策略必须到位,其中包括组织将如何遵守符合性评估程序,以及它将如何管理对设备的修改。该策略还应包括相关法律要求的识别、资格鉴定、分类和等价处理的过程。概述IVDR过渡的质量计划和质量体系更新计划或技术文件可以证明符合该要求。建立根据欧盟MDR和欧盟IVDR第10条实施的持续改进流程也应作为法规合规战略的一部分考虑。
植入名片:欧盟耐多药法规第18条概述了相关要求。
UDI:欧盟MDR第27条和附件VI以及欧盟IVDR第24条和附件VI概述了这些要求。
新的计划和策略:下表总结了MDR和IVDR要求的经过QMS审核和技术评审评估的计划:
耐多药 |
IVDR |
法规遵从策略-第10条和附件九 |
法规遵从策略-第10条和附件九 |
风险管理计划-附件I |
风险管理计划-附件I |
临床发展战略-第61条 |
|
临床评估计划-附件二,附件九,附件十四,附件十五 |
业绩评价计划-附件九,附件十三 |
临床发展计划-附件十四 |
临床表现研究计划-附件十三,附件十四 |
临床研究计划-附件十五 |
临床表现研究计划-附件十三,附件十四 |
上市后监察计划-附件III |
上市后监察计划-附件III |
上市后临床随访计划-附件十四 |
上市后业绩跟踪计划-附件十三 |
适用于欧盟MDR的临床评估:第61条规定,对于用于给药和/或移除药品的所有III类器械和IIb类器械,生产商可以在临床评估或调查之前向专家小组咨询其临床开发策略。制造商应适当考虑专家组的意见。这种考虑应记录在临床评估报告中。
安全性能总结:对于可植入设备,III类设备,以及C类和D类体外诊断设备,制造商必须以一种对预期用户和患者都清楚的方式编写一份安全性和临床性能的总结。公告机构应审查并将该信息提交给EUDAMED,以使其向公众开放。在这个总结中,制造商需要包括一些要求,如:基本的uddi - di信息、SRN、器械描述和用途、统一标准的参考、临床和/或性能评估总结、上市后随访的相关信息、对用户的建议培训以及关于残留风险、不良影响、警告和预防措施等方面的信息。对于体外诊断设备,指定值的计量溯源性也应包括在本摘要中。
实现过程中见证的典型挑战
组织必须记住,在对MDR或IVDR进行质量管理体系评估时,必须根据EU MDR和EU IVDR第10条对所有器械组建立质量管理体系,形成文件,并可运行(在实际情况下):制造商的一般义务.通知机构现在必须仔细审查许多要求,如果不适当地实施,这些要求可能最终导致不符合要求。例如:
法规遵从策略,包括遵从符合性评估程序和系统覆盖的设备修改管理程序
组织经常会不经意地为法规遵从性定义一种策略,该策略没有涵盖受法规约束的所有产品类型或所有符合性评估路径。为了避免不符合,进行彻底的评估以确认策略包含认证范围内的所有适用产品是很重要的。
此外,在审计过程中,如何证明对整个供应链中的经济运营商的控制和监控是一项法规遵从性挑战。这可以通过文件化的质量协议成功地完成,这些协议概述了分销商、进口商、装配商和授权代表的新职责,但重要的是,在评估之前,这些协议必须正式生效。每一经济经营者应当能够检查所有其他有关经济经营者的合规性。例如,经销商必须验证CE标志和欧盟符合性声明、标签、使用说明(IFU)和UDI;进口商应该能够验证指定的授权代表,并保持标签/包装的细节,而授权代表必须验证来自制造商的技术文件和合格评估,并有权获得合格声明和技术文件。
确定适用的一般安全和性能要求,并探索解决这些要求的选项
组织必须对整个质量体系新的安全和性能要求进行影响评估,而不是将其作为孤立的要求进行管理。例如,风险管理文件必须包括这些要求的影响,包括缓解活动。
资源管理,包括供应商和分包商的选择和控制
必须定义负责法规遵从性的人员的资格和经验,并提供支持这些标准的记录。如果公告机构不能核实此信息或得出资历/经验不足的结论,公司将不能遵守此要求。除了文档可用之外,组织还需要能够证明负责法规遵从性的人员是永久和持续可用的,以支持他们;对于分包商,这可以通过文件化的协议进行管理,但重要的是不要忽视这一要求。
此外,重要的是显示在市场后监测中过渡和过渡后要求的资源分配,并确保合法制造商持有设备的所有技术文件。这可以通过质量管理评审记录和其他记录来证明资源管理正在组织的高层考虑。
附件I第3节所述的风险管理
风险管理不能作为一个孤立的过程来实施。为了成功地证明风险管理是正确实施的,来自风险管理的结论必须与临床表现数据相联系。IFU中的索赔要求必须与科学有效性以及分析和临床绩效数据相联系,这些数据也应在绩效评估报告(PER)中引用。重要的是,组织适当地处理所有危害的利益-风险,并有一个明确的理解危害与危害的概念。
IVDR:绩效评估,根据第56条和附件XIII,包括上市后绩效跟踪(PMPF)
PMPF用于确认市场上器械的安全性和有效性。如果在性能评估和风险管理活动中确认该设备是安全的,则不需要进行PMPF研究,除非在上市后监测活动中发现问题。PMPF的一个重要方面是确认器械预期用途的收益-风险比没有受到不利影响。
绩效评估应该通过客观的回顾来进行,必须考虑有利和不利的数据。评估的深度和程度必须与设备的特征(包括风险、风险等级、性能和预期用途)成比例和适当。评价的产出应导致制定计划公积金计划。如果结论是PMPF研究不需要,这必须在PER中得到证明。
绩效评估应是由绩效评估计划驱动的持续过程。预期用途对于确定所需的临床证据是重要和关键的,科学有效性应与所作的声明联系起来。这是所有IVD设备都需要的,即使设备已经在市场上很长时间了。《IVDR》第10条、56条和附件XIII阐述了所有具体要求。
根据所有相关设备进行的UDI分配的验证,并确保所提供信息的一致性和有效性
组织需要确保可以在整个供应链中验证UDI。此外,他们需要验证它是否包含在所有所需位置,例如,技术文档,符合性声明,植入卡,标签/包装和警惕报告。UDI指导文件可用;但是,它主要集中在医疗设备上。因此,重要的是对体外诊断制造商来评估是否自检,靠近患者测试,伴侣诊断和D类设备是否需要实现UDI要求。
建立、实施和维护上市后监控系统
上市后的监督应考虑到整个产品生命周期,如设计、制造、货架期、使用寿命和处理。应实施上市后监测和上市后性能跟踪程序(用于IVDR),并对每种器械类别有特定的频率要求。警惕性报告要求包括严重事故系统的实施、现场安全纠正措施和趋势报告。
各组织必须有处理报告要求的程序,包括监测警戒趋势的可靠统计方法。例如,严重的公共卫生威胁必须在两天内报告,死亡或意外的健康状况严重恶化必须在10天内报告,任何其他事件必须在15天内报告。
定期安全更新报告(PSURs)和安全与临床表现总结(SSCP)是强制性报告,必须以不同的频率提交,总结如下:
设备 |
定期安全更新报告(PSUR) |
安全性与临床表现综述(SSCP) |
课上我 |
必要时更新PMS报告 |
|
类活动花絮 |
必要时;至少两年一次 |
|
IIb类 |
年度 |
|
IIb类植入 |
每年通过EUDAMED通知机构 |
每年通过EUDAMED通知机构 |
第三类 |
每年通过EUDAMED通知机构 |
每年通过EUDAMED通知机构 |
试管一 |
||
试管B |
||
试管C |
如有必要,请尽快 |
|
试管D |
如有必要,请尽快 |
组织应核实程序已更新,以确保这些活动按要求的频率进行,并相应更新与所有适用的经济操作者的协议,以避免潜在的不符合。
医疗设备组织现在被要求有几个系统的流程,这些流程要服从许多新的欧盟要求,这些要求主要集中在安全性和性能上。整个供应链的经济型运营商必须采用更快的产品开发周期,保持质量,并保持符合行业法规。虽然有许多新的特定需求可能会被无意中忽略,并且需要大量的资源来实现新的需求,组织可以从遵循指导方针和充分组织其质量管理体系中的数据中受益,以提供法规要求的清晰关联,以及组织如何遵从每个设备的法规要求。此外,准备和组织欧盟耐多药和欧盟IVDR合规所需的技术文件也有其独特的挑战;本系列的下一部分将探讨它们,包括在公告机构评估期间避免陷阱的一些考虑。
关于作者:
 Marcelo Trevino是Agendia的全球副总裁,负责监管事务和质量保证,Agendia是一家专注于乳腺癌基因组检测的分子诊断公司。他在质量和监管事务方面拥有超过25年的经验,在不同的组织担任高级领导职务,同时管理各种医疗设备:外科心脏瓣膜、患者监测设备、胰岛素泵疗法、外科器械、整形外科和医学成像/外科导航等等。他对医疗器械管理系统和全球医疗器械法规(ISO 13485:2016, ISO 14971:2019,欧盟MDR,欧盟IVDR, MDSAP)有广泛的了解。Trevino持有亚利桑那州立大学W.P. Carey School of Business at Arizona State University的工业和系统工程学士学位和供应链管理MBA学位。他也是Exemplar Global认证的质量管理体系首席审核员。可以和他联系marcelotrevino@outlook.com或在LinkedIn.
Marcelo Trevino是Agendia的全球副总裁,负责监管事务和质量保证,Agendia是一家专注于乳腺癌基因组检测的分子诊断公司。他在质量和监管事务方面拥有超过25年的经验,在不同的组织担任高级领导职务,同时管理各种医疗设备:外科心脏瓣膜、患者监测设备、胰岛素泵疗法、外科器械、整形外科和医学成像/外科导航等等。他对医疗器械管理系统和全球医疗器械法规(ISO 13485:2016, ISO 14971:2019,欧盟MDR,欧盟IVDR, MDSAP)有广泛的了解。Trevino持有亚利桑那州立大学W.P. Carey School of Business at Arizona State University的工业和系统工程学士学位和供应链管理MBA学位。他也是Exemplar Global认证的质量管理体系首席审核员。可以和他联系marcelotrevino@outlook.com或在LinkedIn.

