如何对已验证的过程实施持续过程监视
通过马克Durivage,质量体系合规有限责任公司
FDA法规要求:“如果一个过程的结果不能通过后续的检查和测试得到完全的验证,则该 工艺应以高度保证的方式进行验证,并按照既定程序予以批准。”然而,验证只是这个需求的一半。经过验证的过程也必须被控制和监视,这一要求通常被称为持续过程监视。制药、医疗设备和人体组织法规都要求对已验证的工艺进行验证和持续的工艺监控。
工艺应以高度保证的方式进行验证,并按照既定程序予以批准。”然而,验证只是这个需求的一半。经过验证的过程也必须被控制和监视,这一要求通常被称为持续过程监视。制药、医疗设备和人体组织法规都要求对已验证的工艺进行验证和持续的工艺监控。
需求
21 CFR Part 211现行成品药品良好生产规范
第211.110节过程中物料和药品的取样和测试。
(a)为确保药品的批均匀性和完整性,应建立并遵循书面程序,描述对每批适当的批中材料样品进行的过程中控制和测试或检查。应建立这样的控制程序,以监控输出,并验证那些可能导致过程中物料和药品特性变化的生产工艺的性能。
(b)此类特性的有效过程中规范应与药品最终规范一致,并应在可能的情况下由以前可接受的工艺平均值和工艺变异性估计得出,并在适当时由适用的统计程序确定。样品检验和检验应当保证药品和中药材符合规范。
(c)在生产过程中,如在重要阶段的开始或结束时,或在长时间储存后,应酌情对过程中物料进行标识、强度、质量和纯度测试,并由质量控制部门批准或拒绝。
21 CFR Part 820质量体系法规
第820.70节生产和过程控制。
(一)一般。每个制造商应开发、实施、控制和监视生产过程,以确保设备符合其规范。当制造过程可能导致偏离设备规范时,制造商应建立和保持过程控制程序,描述为确保符合规范所必需的任何过程控制。当需要过程控制时,应包括:
(1)规定和控制生产方式的文件化说明、标准操作程序(SOP)和方法;
(2)生产过程中工艺参数和部件、设备特性的监控;
(三)符合规定的参考标准或者规范;
(4)工艺和工艺设备的批准;和
(5)工艺标准应以文件化的标准或通过确定和批准的代表性样品来表示。
21 CFR Part 1271人体细胞、组织、细胞和组织产品
第1271.220节加工和过程控制。
(一)一般。如果您是一家处理HCT/P的企业,则必须以在处理过程中不会造成污染或交叉污染的方式处理每个HCT/P,并防止通过使用HCT/P引入、传播或传播传染病。
(c)过程控制和测试。你们必须确保符合与本节(a)段一致的中控规定要求,并且在完成所需的检查和试验或其他验证活动,或收到必要的批准并形成文件之前,对每个中控HCT/P进行控制。过程中HCT/Ps的取样必须能代表待评估的材料。
监管的行为
在2019年期间,FDA发布了168个检查483个观察结果,特别引用了不充分或缺乏连续过程监控。下表来自2018年10月1日至2019年9月30日期间发布的FDA 483项观察结果。
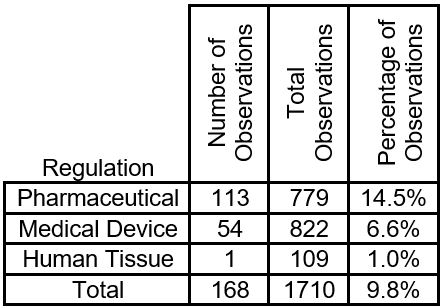
如表所示,总体连续过程监控占FDA发布的483项观察的9.8%。
与引文相关的评论有:
- 你们对样品的检查和测试没有确保药品和中药材符合规范。
- 你们的中制物料和药品抽样和测试的中制规范[与药品最终规范不一致][不是由以前可接受的工艺平均值和工艺变异性估计值推导出来][不是由适用的统计程序决定的]。
- 未[充分]建立过程控制程序,该程序描述为确保符合规范所必需的任何过程控制。
- 没有[开发][实施][控制][监控]生产流程以确保设备符合其规格。
- HCT/Ps的处理方式[不会在处理过程中造成污染或交叉污染][不会增加引入、传播或传播传染病的风险]。
持续的过程监控
过程验证后,应根据产品或过程所涉及的风险,制定持续过程监视计划。第一步是确保工艺参数的设置和维护在验证期间建立的范围内。
我用于持续过程监控的最有用的工具包括验收抽样、定期检查和控制图表。在这些技术中,接受抽样是最不可取的,因为抽样不是实时执行的,不允许进行工艺调整。
定期检查比接受抽样更可取。定期检查可能允许一些工艺调整,但与验收抽样相比,最大的优势是能够将产品托起到最后已知的好部件,从而最大限度地减少进一步加工或分销的不一致产品的风险。对定期检验方法的补充是首次和最后一次检验的实践。初、末件检验也是检验有差异产品的有效方法。
控制图建立在定期检查的基础上,通过绘制过程输出和监控过程的特殊原因变化或趋势。控制图是一种决策工具,为有关最近生产的产品的及时决策提供信息。控制图包含一条中心线(通常是绘制的样本的数学平均值)和上下统计控制限制,这些限制定义了共同原因变化和随时间绘制的性能数据的约束条件。
控制图一般分为两类:变量图和属性图。变量是可以测量的东西。属性是可以计算的东西。数据的类型(变量或属性)将指示监控过程所需的适当类型的控制图。下表可用于控制图的选择。
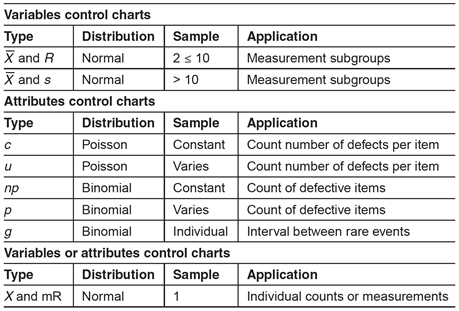
选择正确的控制图类型对于确保基础统计概念适合被测量的特征或属性非常重要。
当控制图没有显示出任何失控的情况,只包含常见的变化原因时,一个过程被称为处于控制状态。如果共同原因的变化很小,那么可以使用控制图来监控过程。如果共同原因变化太大,则需要修改工艺。
当控制图显示出失控的情况(控制范围外的点或与下面规则中的一个或多个标准相匹配的点)时,必须确定和消除可分配的变化原因。
以下规则可以用来正确解释控制图:
规则1 -超过3 σ控制极限的一点
规则2 -在中心线的一边有八个或更多的点,但不要交叉
规则3 - B区或B区以上五分中的四分
规则4 -连续六个或更多的点数稳定增加或减少
规则5 - A区三分之二得分
规则6 - 14点在一行交替上和下
规则7 -任何明显/可预测的模式、周期或趋势
结论
是时候考虑增加你的验证制药、医疗设备,组织生产过程,包括加工,包装,标签,建立持续的过程监控,以确保持续符合规范和要求如果你不想成为一个被FDA的9.8%。
建立文档化的程序来管理所使用的工具和方法的重要性再怎么强调都不为过。最佳实践包括为您的组织使用持续过程监视工具和活动提供基本原理。本文中介绍的需求和持续过程监控工具可以并且应该基于行业实践、指导文档和法规要求来使用。
引用:
- Durivage,硕士,2014,实用工程、工艺和可靠性统计,密尔沃基ASQ质量出版社
- Durivage, m.a., Mehta, B., 2016,实用工艺验证,密尔沃基,ASQ
质量按
- https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfCFR/CFRSearch.cfm?CFRPart=211
- https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfCFR/CFRSearch.cfm?CFRPart=820
- https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfCFR/CFRSearch.cfm?CFRPart=1271
- https://www.fda.gov/inspections-compliance-enforcement-and-criminal-investigations/inspection-references/inspection-observations
关于作者:
 Mark Allen Durivage是一名从业者、教育家、顾问和作家。他是Quality Systems Compliance LLC的管理首席顾问、ASQ Fellow和SRE Fellow。Durivage主要与fda监管行业(医疗器械、人体组织、动物组织和制药)的公司合作,专注于质量管理体系的实施、整合、更新和培训。此外,他通过提供内部和外部审计支持以及FDA 483和警告信响应和补救服务来帮助公司。他获得了锡耶纳海茨大学的计算机辅助加工学士学位和东密歇根大学的质量管理硕士学位。他持有CRE、CQE、CQA、CSSBB、RAC(全球)和CTBS等多个认证。他写了几本书,可以在ASQ质量出版社找到,并在质量进步,并且是生命科学连接的频繁贡献者。你可以通过mark.durivage@qscompliance.com和他联系LinkedIn.
Mark Allen Durivage是一名从业者、教育家、顾问和作家。他是Quality Systems Compliance LLC的管理首席顾问、ASQ Fellow和SRE Fellow。Durivage主要与fda监管行业(医疗器械、人体组织、动物组织和制药)的公司合作,专注于质量管理体系的实施、整合、更新和培训。此外,他通过提供内部和外部审计支持以及FDA 483和警告信响应和补救服务来帮助公司。他获得了锡耶纳海茨大学的计算机辅助加工学士学位和东密歇根大学的质量管理硕士学位。他持有CRE、CQE、CQA、CSSBB、RAC(全球)和CTBS等多个认证。他写了几本书,可以在ASQ质量出版社找到,并在质量进步,并且是生命科学连接的频繁贡献者。你可以通过mark.durivage@qscompliance.com和他联系LinkedIn.

