FDA的合格评定认证计划(ASCA)试点计划解释
通过马克Durivage质量系统合规有限责任公司

美国食品和药物管理局(FDA)器械和放射卫生中心(CDRH)和生物制剂评估和研究中心(CBER)最近发布了征求公众意见的公告《合格评定认可计划(ASCA)试点计划指南草案》,适用于行业、认可机构、检测实验室和食品和药物管理局工作人员.
《合格评定认可计划(ASCA)试验计划指引(供业界、认可机构、化验实验室及食物及药物管理局职员参考)草案》该文件旨在更有效地利用FDA的科学资源来保护和促进公众健康,并进一步鼓励医疗器械法规的国际协调。
ASCA试点的合格评定方案将对使用FDA认可的认可机构的检测实验室进行认证。测试实验室将使用与每个合格标准和的要求相关联的程序规范进行认证ISO/IEC 17025:2017:通用要求测试和校准实验室的能力通过认可的认证机构.
ASCA试点总体合格评定方案如下:
- 认证机构可以申请参加ASCA试点
- FDA认可有资格参加ASCA试点
- 检测实验室获得认可认可机构的认可
- 测试实验室可以申请参加ASCA试点
- FDA认可符合ASCA试点资格的检测实验室,并授予ASCA认证
- 设备制造商可以选择asca认可的测试实验室进行测试
- 设备制造商可以在asca认可的检测实验室上市前提交的报告中使用摘要检测报告
FDA打算定期审计认证机构和检测实验室,以确保它们充分满足项目期望。
ASCA计划目标
ASCA试点旨在支持FDA的公共卫生使命,通过增加对来自ASCA认可的检测实验室的检测结果的信心,以及在制造商依赖于由ASCA认可的检测实验室完成的检测时,潜在地减少单个上市前提交的负担。ASCA项目的目标是:
- 增强对医疗仪器测试的信心
- 促进上市前评审过程的一致性和可预测性
- 鼓励有效使用FDA资源
- 提高监管效率
- 支持国际协调
ASCA程序规范
ASCA程序有超出ISO/IEC 17025要求的额外要求。这些额外的要求是根据利益相关方在题为“医疗器械符合食品和药物管理局认可标准的合格评定认证计划”的公共研讨会上的投入制定的。
ASCA ISO/IEC 17025章节以及附加的医疗器械生物评估程序规范见表1。具体要求请参见附录A: ASCA医疗器械生物评价程序规范.
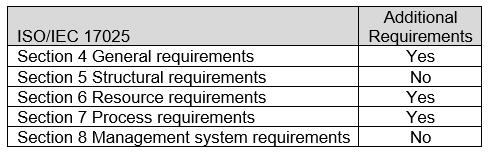
表1
ASCA医疗器械生物评价试点项目包含的测试方法包括:
- ASTM F756:材料溶血性能评定的标准实施规程
- ISO 10993 - 4:医疗器械的生物学评价。第4部分:与血液相互作用试验的选择
- ISO 10993 - 5:医疗器械的生物学评价。第5部分:体外与血液相互作用的试验细胞毒性
- ISO 10993 - 10:医疗器械的生物学评价。第10部分:刺激和皮肤致敏试验
- ISO 10993 - 11:医疗器械的生物学评价。第11部分:全身毒性试验
- USP < 151 >:热原质试验
- ISO 10993 - 12:医疗器械的生物学评价。第12部分:样品制备和参考材料
ASCA ISO/IEC 17025章节附加了医疗电气设备、医疗电气系统和实验室设备的基本安全和基本性能程序规范,见表2。具体要求请参见附录B: ASCA医疗电气设备、医疗电气系统和实验室设备的基本安全和基本性能规范。
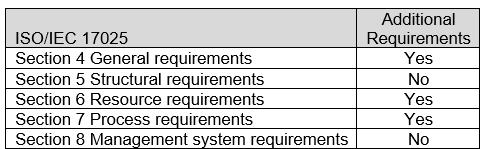
表2
ASCA医疗设备和实验室设备基本安全和基本性能试点中包含的测试方法包括:
- ANSI / AAMI ES60601-1:医用电气设备。第1部分:基本安全和基本性能的一般要求(连同fda认可的抵押品和60601/80601家族的特殊标准)
- IEC 61010 - 1:测量、控制和实验室用电气设备的安全要求。第1部分:一般要求(连同fda认可的61010系列特定标准)
角色和职责
参与ASCA试点的认可机构将认可使用ISO 17025规范的测试实验室,加上ASCA计划规范,包括医疗设备的生物学评价、医疗电气设备、医疗电气系统和实验室设备的基本安全和基本性能是合适的。参与ASCA试点的测试实验室将按照这些相同的规范进行测试。
与此同时,认证机构将需要修改他们现有的评估工具,以确保符合附加的ASCA项目规范,包括医疗设备的生物学评价、医疗电气设备、医疗电气系统和实验室设备的基本安全和基本性能,如适当。类似地,测试实验室将需要执行差距评估,以确保符合附加的ASCA程序规范。
器械制造商可以自愿选择使用参与ASCA试点的检测实验室进行上市前提交给FDA的检测。器械制造商负责在其上市前提交中包含适当的器械检测信息,并确保标准被适当选择和使用,以及在上市前提交中提供的符合性声明是一致的在医疗器械上市前申报中适当使用自愿共识标准.
FDA工作人员负责确保过程和政策的一致实施,并为ASCA试点参与者提供必要的培训,以保持FDA对ASCA认可的检测实验室提交的检测的信心。此外,FDA必须确保参与ASCA试点的认证机构始终符合其继续参与项目的指定标准。
FDA工作人员将根据现有法律、法规和指导对上市前提交的文件进行审查。管理ASCA试点的FDA工作人员与进行上市前审查的FDA工作人员是独立的。
结论
FDA最近在组织、结构和理念上的变化对医疗器械行业来说是一个积极的信号。这个提议的新项目旨在使FDA和制造商的监管提交过程更有效。
我强烈建议寻求参与ASCA项目试点的测试实验室对ISO/IEC 17025附录a和附录B中提供的附加要求进行全面的差距评估《合格评定认可计划(ASCA)试点计划指南草案》,适用于行业、认可机构、检测实验室和食品和药物管理局工作人员在向认可认可机构寻求认可之前。
FDA要求所有关于指导草案和计划本身的意见在这里提交不迟于2019年12月23日。
关于作者
 马克·艾伦Durivage曾是一名实践者、教育家、顾问和作家。他是Quality Systems Compliance LLC的管理首席顾问,ASQ研究员和SRE研究员。他在锡耶纳高地大学获得计算机辅助加工学士学位,在东密歇根大学获得质量管理硕士学位。他拥有多个认证,包括;CRE、CQE、CQA、CSQP、CSSBB、RAC(全局)和CTBS。他写了几本书,可以通过ASQ质量出版社获得,在质量进步上发表文章,并经常为生命科学连接撰稿。Durivage居住在密歇根州的兰伯特维尔。请随时给他发邮件有任何问题或意见。
马克·艾伦Durivage曾是一名实践者、教育家、顾问和作家。他是Quality Systems Compliance LLC的管理首席顾问,ASQ研究员和SRE研究员。他在锡耶纳高地大学获得计算机辅助加工学士学位,在东密歇根大学获得质量管理硕士学位。他拥有多个认证,包括;CRE、CQE、CQA、CSQP、CSSBB、RAC(全局)和CTBS。他写了几本书,可以通过ASQ质量出版社获得,在质量进步上发表文章,并经常为生命科学连接撰稿。Durivage居住在密歇根州的兰伯特维尔。请随时给他发邮件有任何问题或意见。

