定义和测量QMS过程
通过马克Durivage,质量体系合规有限责任公司

定义和测量质量管理体系(QMS)过程是一个经常被忽视的需求ISO 13485:2016医疗器械-质量管理体系-监管目的的要求.ISO 13485要求每个组织确定维持质量管理体系所需的过程,监视和测量这些过程,并在未达到预期结果时实施纠正措施。
当活动被考虑、管理和理解为作为一个系统运作的相互关联的过程时,可预测的和一致的过程结果可以更有效和高效地获得。认识到质量管理体系由几个相互关联的过程组成,了解相互关联的过程系统如何产生结果,使组织能够优化系统及其绩效。
ISO 13485过程要求
- 质量管理体系
- 4.1.2 -组织应:a)确定质量管理体系所需的过程,并考虑组织所承担的作用在整个组织中应用这些过程:b)应用基于风险的方法控制质量管理体系所需的适当过程;c)确定这些过程的顺序和相互作用。
- 5.6 -管理评审
- 5.6.1总则——组织应将管理评审的程序形成文件。最高管理者应按文件化的策划时间间隔对组织的质量管理体系进行评审,以确保其持续的适宜性、充分性和有效性。评审应包括评价质量管理体系改进的机会和变更的需要,包括质量方针和质量目标。
- 5.6.2评审输入——管理评审的输入应包括但不限于:e)过程的监视和测量产生的信息。
- 8.2.5 -过程的监视和测量
- 组织应应用适当的方法对质量管理体系过程进行监视,并在适当时进行测量。这些方法应证明过程实现所策划结果的能力。当计划的结果未达到时,应酌情采取纠正和纠正措施。
什么是流程?
ISO 9000:2015质量管理体系基础和词汇将流程定义为“使用输入来交付预期结果的一组相互关联或相互作用的活动”。预期结果进一步定义为过程输出。在最简单的形式中,流程接受输入,执行增值活动,从而得到预期的输出(图1)。

图1 -流程示例
在确定QMS过程时,我喜欢使用四个首字母缩写词——COPS、SOPS、AOPS和MOPS——来对过程进行分类。它们被定义为:
- 面向客户的流程代表组织的核心工作,对客户有直接影响。例子包括但不限于:设计和开发、生产、报价、运输、安装和服务。
- 面向支持的过程启用核心流程并对客户产生间接影响。例子包括但不限于:财务、采购、供应商管理、培训、文件控制、记录控制、检验活动、维护和校准。
- 面向评估过程(AOPs)监控客户、支持和管理流程,并间接影响客户。这些例子包括但不限于:内部审核、数据分析、纠正和预防措施(CAPA)、不符合项、客户满意度和管理评审。
- 面向管理的过程是实现核心流程并对客户有间接影响的管理职责领域。例子包括但不限于:组织环境、相关方、质量方针、质量目标、计划、资源管理(人力、设施、设备、基础设施)、沟通和以客户为中心。
必须注意的是,过程类别将根据组织提供的产品和服务而有很大差异。例如,校准通常被认为是一个SOP。然而,提供校准服务的公司很可能会将校准视为COP。
示例流程
组织已经将设计和开发确定为COP(表1)。
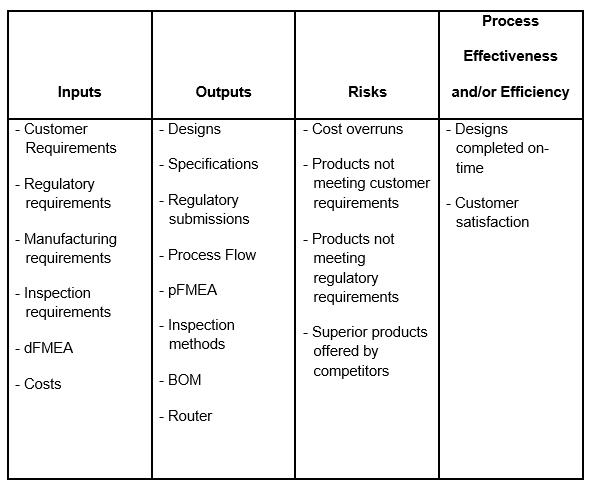
表1 -设计和开发过程示例
表1确定了过程的输入、输出、风险和过程有效性和/或效率的度量。需要为每个COP、SOP、AOP和MOP创建相同的表。本组织还可以考虑确定这一进程的机会,以及缓解和分析的程序。
过程方法审核
传统的基于条款的审计通常利用检查表通过检测不符合项来确保符合标准,但没有为管理层提供有关过程有效性和/或效率的有意义的信息(参见8.2.5过程的监视和测量).
过程方法审计传统上使用Turtle图,它首先由Philip Crosby引入。Crosby的海龟图(图2)建立在传统的供应商、输入、过程、输出、客户(SIPOC)图的基础上。
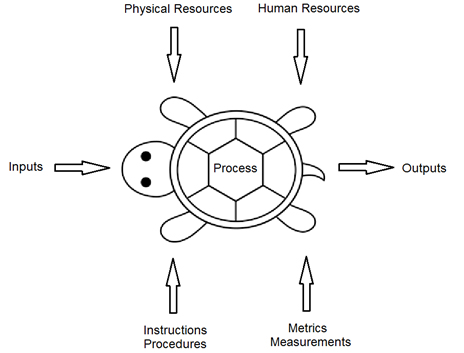
图2 -海龟图示例
过程方法审计:
- 关注流程在其生命周期中从输入、处理、输出到最终改进的执行情况。
- 专注于检测过程中的低效或不符合,而不是在一组过程输出中寻找单个的不符合。
- 确保流程活动被定义、可测量、增加价值、高效、受控,并提供与业务目标相对应的输出。
结论
法规、标准和指导性文件要求组织识别、控制和改进质量管理体系运行所需的过程。将流程识别并归类为cop、SOPs、AOPs和MOPs有助于促进遵从性。过程方法审计帮助组织确保过程是定义的、可测量的、增加价值的、有效的、受控的,并提供与业务目标相对应的输出。
作者简介
 Mark Allen Durivage曾担任执业医师、教育家、顾问和作家。他是Quality Systems Compliance LLC的管理首席顾问,ASQ研究员和SRE研究员。Durivage主要与FDA监管行业(医疗器械、人体组织、动物组织和制药)的公司合作,专注于质量管理体系的实施、集成、更新和培训。此外,他还协助公司提供内部和外部审计支持,以及FDA 483和警告信响应和补救服务。他在锡耶纳高地大学获得计算机辅助加工学士学位,在东密歇根大学获得质量管理硕士学位。他拥有多项认证,包括;CRE, CQE, CQA, CSSBB, RAC (Global)和CTBS。他写了几本书,可通过ASQ质量出版社获得,在质量进展中发表文章,并且是生命科学连接的频繁贡献者。Durivage住在密歇根州的兰伯特维尔。请随时给他发电子邮件mark.durivage@qscompliance.com有任何问题或意见。
Mark Allen Durivage曾担任执业医师、教育家、顾问和作家。他是Quality Systems Compliance LLC的管理首席顾问,ASQ研究员和SRE研究员。Durivage主要与FDA监管行业(医疗器械、人体组织、动物组织和制药)的公司合作,专注于质量管理体系的实施、集成、更新和培训。此外,他还协助公司提供内部和外部审计支持,以及FDA 483和警告信响应和补救服务。他在锡耶纳高地大学获得计算机辅助加工学士学位,在东密歇根大学获得质量管理硕士学位。他拥有多项认证,包括;CRE, CQE, CQA, CSSBB, RAC (Global)和CTBS。他写了几本书,可通过ASQ质量出版社获得,在质量进展中发表文章,并且是生命科学连接的频繁贡献者。Durivage住在密歇根州的兰伯特维尔。请随时给他发电子邮件mark.durivage@qscompliance.com有任何问题或意见。

