用ISO 14971:2019结束风险管理循环
通过埃德温账单、顾问
这是医疗器械风险管理标准ISO 14971变化系列文章中的第二篇 于2019年12月发布,并得到ISO TR 24971:2020医疗器械风险管理标准技术报告或指南指南的支持。对标准和技术报告进行了重组,并在两个文件中对医疗器械风险管理的概念进行了澄清。这个过程中很少有变化,但本文涵盖了这个过程中的主要变化:标准第10条款中包含的生产和后期信息。本系列的第1部分介绍了风险可接受标准和策略.本系列的下一篇也是最后一篇文章将介绍收益-风险评估的主题。
于2019年12月发布,并得到ISO TR 24971:2020医疗器械风险管理标准技术报告或指南指南的支持。对标准和技术报告进行了重组,并在两个文件中对医疗器械风险管理的概念进行了澄清。这个过程中很少有变化,但本文涵盖了这个过程中的主要变化:标准第10条款中包含的生产和后期信息。本系列的第1部分介绍了风险可接受标准和策略.本系列的下一篇也是最后一篇文章将介绍收益-风险评估的主题。
我们是如何来到这里的?
随着时间的推移,医疗设备的风险管理开始发展,始于1994年发布的关于风险分析的欧洲标准EN 1441。这就产生了一个国际风险分析标准,ISO 14971 - 1这部电影于1998年上映。国际标准的开发人员意识到,除了简单的风险分析,还有更多的事情要做,并立即着手开发一个标准来管理整个风险过程ISO 14971:风险管理在医疗器械中的应用,首次发布于2000年。该标准定义了医疗设备风险管理的整个生命周期的管理,包括体外医疗设备。在制定标准时讨论的考虑之一是医疗器械开发后,特别是产品放行后的风险管理过程的延续。
在2000版的ISO 14971的最后一节中,介绍了结束生命周期的一节,内容是关于信息的后期反馈。该条款非常简短,包括设备制造商的责任,包括生产后信息评估步骤:
应评估这些信息与安全的可能相关性,特别是以下方面:
A)如果存在以前未识别的危害;
B)由危害引起的估计风险不再是可接受的;
C)如果原来的评估是无效的。
第二版的标准(2007)认为,这个过程似乎从设计和开发到后期制作,因此跳过生产阶段,所以最后一个条款的标题是扩大生产和后期制作”,表明有信息应该检查的生产阶段,类似于后期制作的信息。标准的用户认为没有足够的信息来执行所要求的活动。按照ISO的要求,每五年进行一次标准审查;在对2000年版最终草案进行表决时,国家委员会的意见之一是就如何实施这一要求提供更多的指导。在这一点上,由于ISO规则,不能做进一步的更改,所以这些评论被提交到下一个版本。
投票赞成ISO 14971 2007版的最终草案,用户再次提交了评论,要求更多关于制作和后期信息条款的信息,以及其他主题。由于这些评论和其他的,一个项目开始创建一个技术报告,通过一个技术报告来处理在投票过程中收到的评论,而不是等待标准的下一次更新。医疗器械风险管理技术报告时,ISO TR 24971:2013,其中有一节(三页的指导和一页的流程图)介绍了所涉及领域中的制作和后期信息。
然而,技术报告并没有得到很好的推广,甚至很少有人意识到它是可用的。这个问题可能是由于标准制定后的技术报告,与文档之间没有联系。在2016年投票更新标准和技术报告之后,一个团队被指定专门解决这些问题。该团队将为设备生命周期的生产和后期生产阶段开发更多信息,以满足上市后监管要求,并与ISO 13485:2016要求保持一致。作为一个结果,ISO 14971的2019版提供标准中技术报告的注释,从而链接文档。
ISO 14971:2019修订
希望随着该标准2019年版的发布,该标准有1.5页的要求,以及ISO TR 24971:2020技术报告中4.5页的参考指南,行业更加意识到该标准的扩展要求。重要的是要理解,ISO 14971:2019与EN ISO 14971:2019是相同的,下面的所有讨论都适用于任何一个版本的标准的合规活动。
修订这一条款的另一个原因是欧盟和美国FDA扩大了对上市后监督的监管要求。上市后的监测现在是ISO技术报告的主题,ISO TR 20416:2020中引用的ISO TR 24971.创建技术报告20416是为了衔接ISO 13485:2016要求和ISO 14971:2019要求,并展示它们如何解决MDR和FDA法规和指南中出现的上市后监测的监管要求。这些法规要求也导致了ISO 13485在其2016版的修订。这两个标准,ISO 14971和ISO 13485,都依赖于GHTF/SG3/N18:2010纠正措施和预防措施及相关质量管理体系过程的指导为他们的修订提供指导。GHTF文件中包含的信息比任何一项标准中包含的信息都要广泛,在开发或修订风险管理体系和质量管理体系时,可以参考GHTF文件中的附加信息。(风险管理体系包含在ISO 14971:2019的第4条中,开发的概念是为了满足欧洲新的医疗器械法规[MDR]/体外诊断法规[IVDR]的法规要求。)
在2019年版中,从一开始就作为标准一部分的流程图进行了轻微修改,但没有在循环的结束部分进行修改。标准总是要求在后期制作阶段审查的信息被反馈到过程的开始,以便根据需要审查和更新风险管理过程活动(参见下面的图1)。
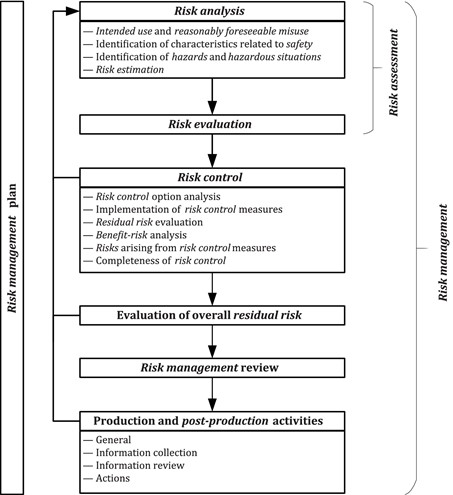
图1:ISO 14971:2019风险管理过程的示意图
根据法规要求,14971的2019版现在要求一个积极的过程:
- 信息的收集
- 信息审核
- 行动(根据评审的要求)。
制造商再也不能坐在电话旁等待投诉了。
ISO 14971:2019条款10.1规定:制造商建立、记录并保持一套系统积极收集和审核信息涉及医疗器械的生产和后期制作阶段”(我强调)。注意这里的“主动”这个词;制造商必须寻找有关产品及其风险的信息,任何新的危害,以及任何“技术状态”的变化,而不是等待投诉。其他信息来源应在积极和持续的过程中审查。其目的是确保风险管理文件包含对产品风险的准确估计,并确保产品风险符合“最新技术”和特定设备的效益。总体剩余风险评估现在包括所有情况下的效益评估,而不仅仅是当整体剩余风险被认为不可接受时。ISO TR 24971:2020提供了4.5页关于设备生命周期的生产和后期生产阶段的指导,包括开发符合该标准要求的流程的一些示例。
信息的收集
ISO TR 24971:2020的表7包含了制造商可能从数据源收集的信息示例,它还包含了ISO TR 24971中标识的数据源中的数据元素示例。这张桌子是由GHTF/SG3/N18:2010纠正措施和预防措施及相关质量管理体系过程的指导.表7,以及GHTF CAPA指南SG3/N18中的附件B表,对于作为制造商的你们在开发信息收集流程时,对于在收集信息时应该审查哪些内容的想法,将非常有用。
信息审核
有趣的是,在2019年版的标准中,上述ISO 14971:2000问题只进行了轻微的修订,继续推动过程:
制造商应审查收集的信息是否与安全有关,特别是是否:
-存在以前未被承认的危险或危险情况;
-因危险情况而产生的估计风险已不再可接受;
- - -与预期用途的益处相比,总体剩余风险不再是可接受的;或
一般公认的技术状态已经改变了。
(强调我的。)
注意,在总体剩余风险分析中加入了“效益”。在所有情况下,总体剩余风险都是根据收益来衡量的,它也反映在产品生命周期的后期生产阶段。
行动
制造商在动作部分有两个要求需要满足:
- 您必须确定设备的剩余风险是否可接受。随后,您必须确定是否需要采取行动,将市场上已经上市的设备和您目前控制的设备的风险转移到可接受的程度。
- 你必须确保风险管理过程本身是充分的。本活动与ISO 13485 5.6中的管理评审和ISO 14971 4.2中要求管理人员评审风险管理过程的适宜性有关。
结论
基于广泛的变化在标准条款10中,所有的医疗设备制造商和体外医疗设备将需要广泛的审查和可能改变他们的生产和后期制作活动部分的质量系统,以满足新需求的风险管理标准。虽然一些公司可能已经开始根据ISO 13485:2016和第8条“测量、分析和改进”的要求对其质量体系进行更改,但这些更改可能不足以满足新的ISO 14971:2019的要求。ISO TR 20416说明了上市后监督、质量管理体系和风险管理体系之间的关系。
你们需要满足新的欧盟MDR和IVDR的监管要求,如上市后监测和上市后临床随访。FDA还制定了一系列关于收益-风险的指南包括FDA上市后行动指南,关于医疗器械产品可获得性、合规性和实施决策的利益-风险考虑因素发布于2016年底,包含了开发一种设备的风险和收益的有用考虑,至少从FDA的角度来看是这样。创建修订后的ISO 14971:2019的ISO委员会试图在制定修订标准时考虑到这些监管要求,因此,标准的实施对满足监管要求大有帮助。
![埃德温账单]() 关于作者
关于作者
Edwin L. Bills已经成为ISO TC 210 JWG1的成员超过20年。这是一个负责医疗器械风险管理以及创建和维护ISO 14971:2019(医疗器械风险管理标准)和ISO TR 24971:2020(伴随的风险管理指南)的ISO小组。


 关于作者
关于作者