ASTM E3263-20:药品生产设备和医疗器械残留目视检验合格的标准实施规程
作者:Andrew Walsh, Ralph Basile, Ovais Mohammad, Stéphane Cousin, Mariann Neverovitch, Osamu Shirokizawa
目视检查多年来已被广泛应用于制药、生物制品、医疗器械等行业清洗后释放制造设备和装置。然而,目视检查从未被证明是一种有效、可靠或安全的检查方法。最近,欧洲药品管理局(EMA)发布了问答1的指南,该指南描述了在生产设备放行时,必须满足什么样的目视检查标准。需要某种形式的指导或标准来指导这些行业如何满足这些标准,并证明操作人员/质量保证检验员有能力和资格准确评估生产设备或医疗设备上残留物的缺失或存在。这篇文章讨论了ASTM国际(美国测试和材料学会)关于外观检验资格的标准规范的发展和出版。
视觉检查的历史和监管视角
自1979年以来,美国法规要求“生产设备在使用前立即进行检查”。2虽然该法规没有明确规定检查应该是“目视的”,但在实践中,制药制造商已经基于目视检查放行设备很多年了,行业和监管机构已经开始将这种检查视为目视检查的要求。然而,在整个过程中,只有少数研究进行了目视检查,与不同的结果报告。对这一说法的另一个误解是,许多公司只在清洗后的设备重新组装后,“在使用前”对设备进行检查。在重新组装后,设备表面的大部分可能是看不见的,因此它们不能被检查和确认为目视清洁。目视检查应在清洗过程后进行之前任何设备的重新组装。
1993年,一篇文章3.发表的一篇文章提到,spike研究表明,许多化合物在大约“每2 x 2英寸棉签区域100 μg”(或大约4 μg/cm2).这4μg / cm2尽管作者没有提供任何数据或任何其他支持信息,Value很快被许多公司采用为“行业标准”。1994年的另一篇文章称,残留可降至1 μg/cm2通过使用额外的光源。4随后在2000年发表的一篇文章称,残留物下降到大约0.4 μg/cm2几个化合物。5一系列的研究6,7对几种不同的化合物进行了检测,发现其含量在0.4到>之间,10 μg/cm2.三个研究使用不同的加钉技术,将残留均匀地分布在表面,发现一个残留的检测限为3、5和7 μg/cm2.这些检测限是根据ICH Q2计算的8方法,并被发现受到几个因素的影响,包括培训。92010年,oais Mohammad提出使用统计方法(逻辑回归)对这些峰值研究,以更准确地得出可见阈值。10
虽然到目前为止还没有对目视检查识别残留物的能力进行广泛的研究和分析,但监管机构在其使用方面似乎更加灵活。EMA 2015年更新到附件1511现在又说“不是。一般可单独使用本标准,”表明可以使用目视检查独自一人清洁验证在某些情况下.意识到这一声明的重要性,最近的ASTM E3106标准指南12提供以下指导以支持本附件15声明:
"只有在下列情况下,仅用目视检查进行验证是可以接受的风险评估已经表明,风险低,100%可检查设备表面在适当的观看条件下。”(强调)
然而,应该明白的是,监管机构极不可能接受目视检查独自一人对于清洗验证,除非制造商有特殊的理由,如非常低危害的产品,并且仍然可能在清洗验证阶段需要一些分析测试来确认可接受的清洗。最可能使用目视检查的地方独自一人在新的低风险产品在多用途设备上的后续清洗工艺验证(验证)中,之前已经进行了令人满意的清洗工艺验证研究。
在这方面更进一步,药物检验合作计划(PIC/S)13现在声明“……加钉研究应该确定最有效成分可见的浓度,”表明这些卫生机构希望看到目视检查作为半定量工具被更频繁地使用,并对其使用提出了要求。这份关于原料药(APIs)的声明导致一些生产商设立目视检查和相关培训活动,只关注原料药。任何在风险(危害)识别步骤中被识别为危害的化合物,以及在风险分析步骤中被发现为危险的化合物,可能需要包括在目视检查确认和培训计划中。这对于医疗器械制造来说尤其如此,因为清洁剂和加工助剂可能是被识别为风险的化合物,而不是原料药。
在此基础上,EMA于2018年4月16日发布了关于设定基于健康的接触限度指南的Q&A草案的更新。在这个最终版本中,出现了两个新的问题和答案(Q7和Q8),它们直接适用于目视检查的使用。这些问答状态:
迄今为止。在产品转换时,共用设施的设备上,清洁验证完成后,是否需要进行分析测试?
答:除非通过健全的、文件化的质量风险管理(QRM)过程进行证明,否则在每次转换时都要进行分析测试。质量风险管理过程至少应考虑以下各方面:
•清洗过程的可重复性(手动清洗的可重复性通常低于自动清洗);
•产品造成的危害;
•是否可以依靠目视检查来确定设备在HBEL认可的残留限度内的清洁度。
处置。根据Q&A 7进行目视检查的要求是什么?
当采用目视检查来确定设备的清洁度时,制造商应设定一个阈值,在此阈值下,产品很容易被视为残留。这还应考虑到视觉检查设备的能力,例如,在照明条件下和在实地观察到的距离下。
目视检查应包括可能存在污染的所有产品接触面,包括需要拆除设备以进入检查区域和/或使用工具(如镜子、光源、孔镜)进入其他不可见区域的表面。非产品接触面应包括在目视检查中,这些接触面可能保留可能被移出或转移到未来批次的产品。
应备有书面说明,说明所有需要目视检查的区域,并有记录明确确认所有检查已完成。
进行目视检查的操作人员需要在过程中接受专门的培训,包括定期视力测试。他们的能力应该通过实际的评估来证明。
因此,作为清洁验证可用的工具之一,实施目视检查的监管要求现在已经被EMA很好地定义了,所需要的就是如何满足这些标准的详细指导。新的ASTM 3263专门为建立合格的目视检查程序提供必要的指导,以符合这些新阐明的法规期望。
ASTM E55和F04委员会合作
2017年,制药和生物制药产品制造的ASTM E55委员会成员和医疗和外科材料和设备的ASTM F04委员会成员合作编写了一份新的标准指南,导致了E3219推算基于健康的接触限度(HBELs)的标准指南.14开发E3219的团队还包括E3106的成员12团队。E3219的合作已经取得成功,该团队讨论了在其他标准上的合作,这将有利于制药和医疗设备和其他行业,特别是视觉检查的资格。
因此,2019年3月,ASTM网站上启动了一个新的工作项目(WK67425),并为WK67425创建了一个合作区域。最初的E3219和E3106团队被扩展到包括更多的制药和医疗器械行业的利益相关方,以从事该标准的工作(表1)。
表1:WK67425协作区域团队成员
团队成员 |
公司 |
行业专业知识 |
拉尔夫巴西 |
Healthmark工业有限公司 |
医疗设备 |
Dhanapal Boopathy |
齐默Biomet |
医疗设备 |
Stephane表哥 |
GSK疫苗 |
制药 |
Delane戴尔 |
融合性的医疗技术 |
医疗设备 |
Parth德赛 |
秘方实验室公司。 |
制药 |
Jayen Diyora |
奥尼兰姆制药 |
制药 |
克利斯朵夫Gamblin |
Theraxel |
制药 |
Igor Gorsky |
ConcordiaValsource,有限责任公司 |
制药 |
木星格雷厄姆 |
盖辛格健康研究中心 |
医疗设备 |
杰西卡·格雷厄姆博士,DABT |
百时美施贵宝公司 |
制药 |
芭芭拉Kanegsberg |
BFK解决方案有限公司 |
医疗设备 |
里特•Luginbuehl |
布莱塞Swisslube AG) |
医疗设备 |
斯皮罗Megremis |
美国牙科协会 |
医疗设备 |
欧盟Neverovitch |
百时美施贵宝 |
制药 |
穆罕默德Ovais |
制药咨询 |
制药 |
罗德尼·帕克 |
Stryker |
医疗设备 |
维姆Sachdeva |
世界卫生组织 |
制药 |
斯蒂芬•Spiegelberg博士。 |
剑桥聚合物组 |
医疗设备 |
诺玛特纳 |
剑桥聚合物组 |
医疗设备 |
安德鲁·沃尔什 |
医药清洁创新中心 |
制药 |
ASTM E3263的目标
本新标准实施规程的目标是专门为制药生产设备和医疗设备上的残留物的目视检验的确认提供指导。这项新标准将为实现以下六个目标提供指导:
- 一种应用指南E3106中介绍的基于科学、基于风险和基于统计的概念和原则的方法12和E3219。14
- 一种符合21 CFR 211.67(b)的设备清洁度检验合格方法。2
- 一种符合欧洲药品管理局(EMA)附件15的设备清洁度目视检查合格方法。11
- 根据EMA的Q&A指南(Q&A 7和Q&A 8),对设备的清洁目视检查(和目视阈值)进行确认的方法。1
- 将应用ICH Q9中引入的基于风险的原则的方法15因此,清洁验证的努力程度、形式和文件也应与风险程度相称。
- 一种放行生产设备和已制造的医疗设备或清洁度的方法,该方法与美国FDA对其过程分析技术倡议的指导一致。16
ASTM E3263适用范围
E3263提供了统计上有效的程序,用于确定残留物的目视检测极限(也称为目视阈值),并为操作人员/质量保证(QA)检验员提供资格,以执行制药设备表面和医疗设备的目视检查。E3263适用于药品,包括原料药、成品剂型、非处方(OTC)药品、兽药、生物制品、临床用品、医疗器械、化妆品和消费品。E3263可用于所有类型的化学残留物(包括原料药、生物物质、中间体、清洁剂、加工助剂、机加工油等),这些残留物可能残留在生产设备或医疗设备的表面。
E3263标准实践指南
E3263的“程序”部分包含六个主要元素的指导。第一个元素讨论为了实现目视检查程序必须满足什么初始标准。
1.建立目视检查确认程序的初始标准:
- 计算MSSR-必须首先计算所有被检查设备的MSSRs(最大安全表面残留),因为有必要确定必须通过目视检查检测到的最低残留水平。MSSR,以每表面积的质量单位表示(例如,μg/cm)2),计算公式如下(来自ASTM E3106):

![]()
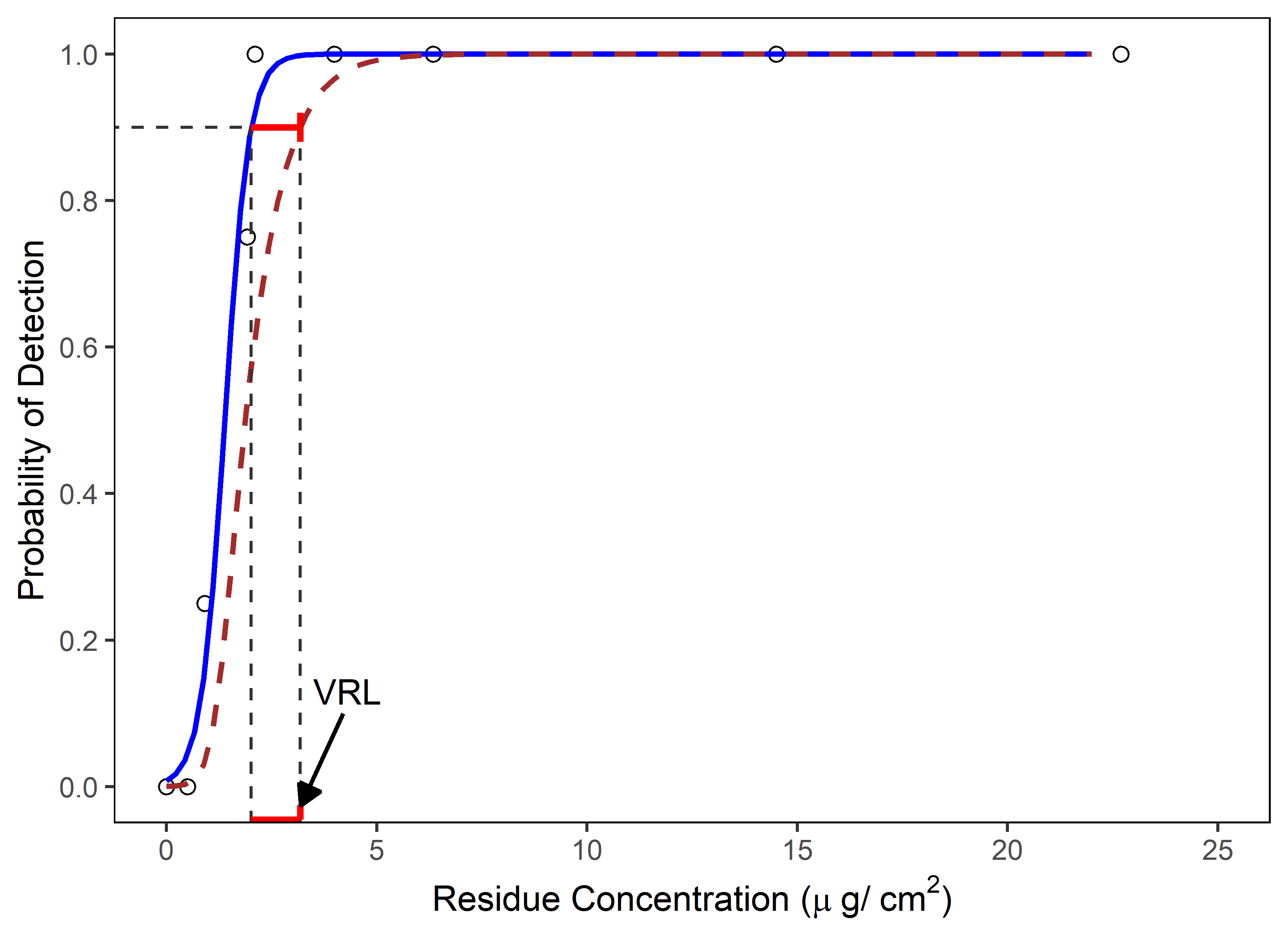
图1 -使用Logistic回归分析确定VRL:蓝色实线是预测的检测概率,棕色虚线是预测概率的95%置信下限。在这个例子中,VRL表示残留浓度在95%的低置信度下,90%的检测概率。(转载自ASTM E3263-20“药品制造设备和医疗器械残留目视检验资格的标准实践”,版权属ASTM国际,Barr Harbor Drive 100, West Conshohocken, PA 19428, USAwww.astm.org.)
4.使用属性协议分析的操作人员/质量保证检验员的资格- - - - - -本节讨论如何建立目视检查研究,通过将检查结果分析为属性数据/二进制数据(即干净数据/脏数据)来确认任意数量的操作员/QA检验员。
5.接受清洗验证的VRL- - - - - -本节讨论如何通过使用目视检测指数(VDI)与MSSR进行比较来确定目视检查是否适合使用。18
6.文档- - - - - -本节讨论建立目视检查程序所需要的关键文件。
HBELs对目视检查的意义
可能实施目视检查最重要的考虑因素是所考虑的化合物的HBEL。1000分之一剂量和10ppm限度已被证明对低危害化合物过于保守,而对高危害化合物不够严格,这没有反映ICH Q9的基于风险的方法。18这种逻辑上的错误扩展到了视觉检查的使用上。一个简单的分析将证明这一点。
本文引用的304种药物化合物的MSSRs19使用表2所示参数计算HBELs和1/ 1000剂量/ 10ppm组合。总设备表面积被选择为典型的包装线,这可以被认为是一个更合适的区域进行目视检查。
表2 MSSR计算的参数假设
参数
价值
批量大小
100公斤
最大程度上的每日剂量
10克
设备总表面积
25000 cm2
HBELs和1/ 1000剂量/ 10ppm组合的MSSRs绘制如图2所示。以10µg/cm为目视残留极限的参考线2已添加,并绘制一个方框,以包含低于或可能过于接近该目视残留限制的化合物,以允许目视检查。从这张图中可以明显看出,许多(如果不是大多数的话)化合物不能进行目视检查。
![]()
图2 -HBELs与1/ 1000和10ppm的MSSRs比较:的о符号表示基于hbel的mssr和∆符号是其相应的mssr从1/ 1000或10ppm的限制计算。(DL =检测限)x轴表示化合物数量。数据oais Mohammad用“R”统计编程语言绘制。
图3显示了相同的图,去掉1/ 1000剂量/ 10ppm组合的MSSRs的∆符号。这个方框现在被绘制成包含超过这个目视残留限制的化合物,并允许目视检查。从这张图中可以明显看出,在hbel中,有很多化合物,特别是低风险化合物,可以考虑进行目视检查。
![]()
图3 -去除1/ 1000和10ppm MSSRs的hbel的MSSRs:oais Mohammad用“R”统计编程语言绘制的数据。
总结
虽然EMA新的Q&A 7和Q&A 8可能会让业内许多人感到惊讶,但它们的添加是为了让那些被发现产品风险较低(基于其HBELs)的公司在产品更换时可以选择使用目视检查。希望从上面的讨论中可以清楚地看到,为了利用目视检查,公司最终必须放弃坚持历史上的千分之一剂量和百万分之十的限制,并实施HBEL。
与此同时,一些公司已经开始对设备放行进行目视检查,在没有任何质量风险管理程序、任何充分的理由或操作人员/QA检查员的任何资格证明的情况下,简单地停止拭子/冲洗测试。这些是不可接受的做法,将不可避免地导致监管行动,导致这些公司的巨大成本和声誉损害。如E3263所述的实现过程应该可以防止这种情况。然而,E3263不能完全独立于ASTM E3106和E3219标准实施,必须与这些指南协调。
再一次,正如“历史和监管视角下的目视检查”一节所说,目视检查独自一人将很有可能在新低风险产品的多用途设备的清洗工艺验证中找到最初的用途。至少在开始阶段,这将要求先前已经存在令人满意的清洗过程验证研究。以下描述的6步质量风险管理过程是实施目视检查的合适程序。
- 新产品的HBEL必须由合格的毒理学家得出,并使用毒性量表与现有产品组合的HBEL进行比较。20.如果危害(毒性)水平是可接受的,产品可以转移到步骤2。
- 应该计算新产品的hbel推导的清洗(拭子)限值,与设备的现有清洗数据进行比较,并计算其潜在的工艺能力评分(Cpu评分)。21如果Cpu评分是可接受的,那么产品可以移动到步骤3。
- 测量新产品的“可清洁性”,并与现有的“最难清洁”产品进行比较。22如果新产品的清洁性是可接受的,那么产品可以移动到步骤4。
- 确定新产品的目视检测限(目视阈值),并计算目视检测指数(VDI)。18如果VDI是可接受的,那么目视检查独自一人可能是有道理的。
- 所有操作员/质量保证检验员对新产品进行目视检查的资格23
- 每批新产品生产后,应对100%(已拆卸的)设备表面进行目视检查,并记录在案。
作者认为,新的E3263标准提供了科学、风险和统计为基础的指导和工具,为公司在质量风险管理程序中实施目视检查提供了必要的工具,该程序符合EMA新的Q&A 7和Q&A 8发布的标准。
同行评审
作者谨感谢Thomas Altman, Joel Bercu, Ph.D., Sarra Boujelben, Alfredo Canhoto, Ph.D., Gabriela Cruz, ph ., Mallory DeGennaro, Parth Desai, Andreas Flueckiger, M.D., Christophe Gamblin, Ioanna-Maria Gerostathes, Ioana Gheorghiev, M.D., Jessica Graham, ph ., DABT, Crystal Hamelburg, Ester lovsen - barle, ph ., Miquel Romero Obon,Prakash Patel, Siegfried Schmitt博士和Joel Young审阅了这篇文章,并提供了深刻的评论和有用的建议。
引用:
- 2018年4月19日,EMA/CHMP/CVMP/SWP/246844/2018。
- 21 CFR 211.67设备清洁和维护
- Fourman, G. L.和Mullen, M. V.,“确定制药生产操作的清洁验证接受限度”,制药技术,17 (4)1993
- 詹金斯,K. M.和Vander Weilen, A. J.,“清洁验证:一个整体的观点”,制药技术,18,(4)1994
- 布斯卡尔费里,洛伦岑,S.,施密特,M.,施温德,H.-M。“Bestimmung der Sichtbarkeitsgrenzen von pharmazeutischen Feststoffen auf Edelstahloberflächen,”Pharm。《工业》,第62卷第6期,2000年。
- 福赛斯,R. J.,范·诺斯特兰德,V.和马丁,G. P.,“清洁验证的可见残留限量及其在制药研究设施中的潜在应用”,制药技术,28(10)2004。
- Forsyth, R. J.和Van Nostrand, V.,“使用可见残留限制将新化合物引入制药研究设施”,制药技术,29(10)2005。
- 国际人用药品注册技术要求协调会议ICH分析方法验证三方指南- ICH Q2 (R1), www.ich.org。
- Desai, P.和Walsh, A.,“目视检查作为清洗验证的分析方法的验证”,《制药在线》,2017年8月。
- “统计上合理的可见残留限量”,制药技术,34(3)2010。
- EudraLex卷4人用和兽医用药品良好生产规范指南,附件15:确认和验证
- 美国测试和材料学会E3106-18e1 "基于科学和风险的清洁工艺开发和验证的标准指南“www.astm.org。
- 药品检验合作计划(PIC/s), https://picscheme.org。
- 美国测试与材料学会E3219-20 "推算基于健康的接触限度(HBELs)的标准指南“www.astm.org。
- 人用药品注册技术要求协调国际会议,ICH协调三方指南,质量风险管理- Q9,步骤4,2005年11月9日,www.ich.org。
- FDA行业指南:PAT -创新药物开发、制造和质量保证框架,2004年9月,美国食品和药物管理局(FDA), www.fda.gov。
- Mohammad Ovais,《统计上合理的可见残留物限制》,《制药技术》,第34卷,第3期,2010年3月。
- 沃尔什,安德鲁,托马斯·奥特曼,阿尔弗雷多·坎霍托,埃斯特·洛夫辛·巴尔,大卫·g·多兰,玛丽安·Neverovitch,穆罕默德·奥维斯,佐木泽和凯利·沃尔德伦。”基于mssr的共享设施中化合物转移检测能力评估量表药学在线2017年12月
- Walsh, Andrew, Michel Crevoisier, Ester Lovsin Barle, Andreas Flueckiger, David G. Dolan, Mohammad oais清洁限制-为什么应该放弃10ppm和0.001剂量标准,第二部分《制药技术40(8)2016》
- Walsh, Andrew, Ester Lovsin Barle, Michel Crevoisier, David G. Dolan, Andreas Flueckiger, Mohammad oais, Osamu Shirokizawa, and Kelly Waldron "用于评估共享设施中产品交叉污染风险的ade衍生量表药学在线2017年5月
- Walsh, Andrew, Ester Lovsin Barle, David G. Dolan, Andreas Flueckiger, Igor Gorsky, Robert Kowal, Mohammad oais, Osamu Shirokizawa,和Kelly Waldron。用于评估共享设施中产品交叉污染风险的工艺能力衍生量表2017年8月
- Song, Ruijin, Alfredo Canhoto, Ph.D., and Andrew Walsh,“清洁过程开发:可清洁性测试和“最难清洁的”制药产品”制药在线2019年1月。
- 美国测试和材料学会E3263-20 "药品制造设备和医疗器械残留目视检验合格的标准实施规程“www.astm.org。