FDA的安全性和基于性能的途径:510(k)申请实质性对等的替代方案
杰弗里·s·埃伯哈德,弗雷尔

自510(k)计划启动以来,医疗器械的510(k)批准一直基于其已证实的与所申请的断言器械的实质等同。为了配合采用最少负担的方法的目标,FDA提供了一种备用路径基于已证实的安全和性能特征,而不是设备与其他谓词的等价性。该途径是缩写510(k)途径的扩展,适用于一些众所周知的低至中等风险II类器械类别。FDA已经发布并将继续发布设备特定指南,以鼓励制造商选择这种方法进行设备审批。FDA还进行在线研讨会以及帮助行业利益相关者理解路径的研讨会。
该途径是自愿的,不是FDA强制的。虽然制造商不需要证明其设备与谓词设备的实质等价性,但制造商仍然需要在提交的范围内识别谓词设备。制造商可以选择安全性和基于性能的途径,如果该设备具有与识别的谓词相同的使用适应症,其技术特性不会引起与识别的谓词不同的安全性和有效性问题,并满足给定设备的fda识别的所有性能标准。如果上述任何一个因素不满足,制造商可以选择提交传统的、特殊的或缩写的510(k)。
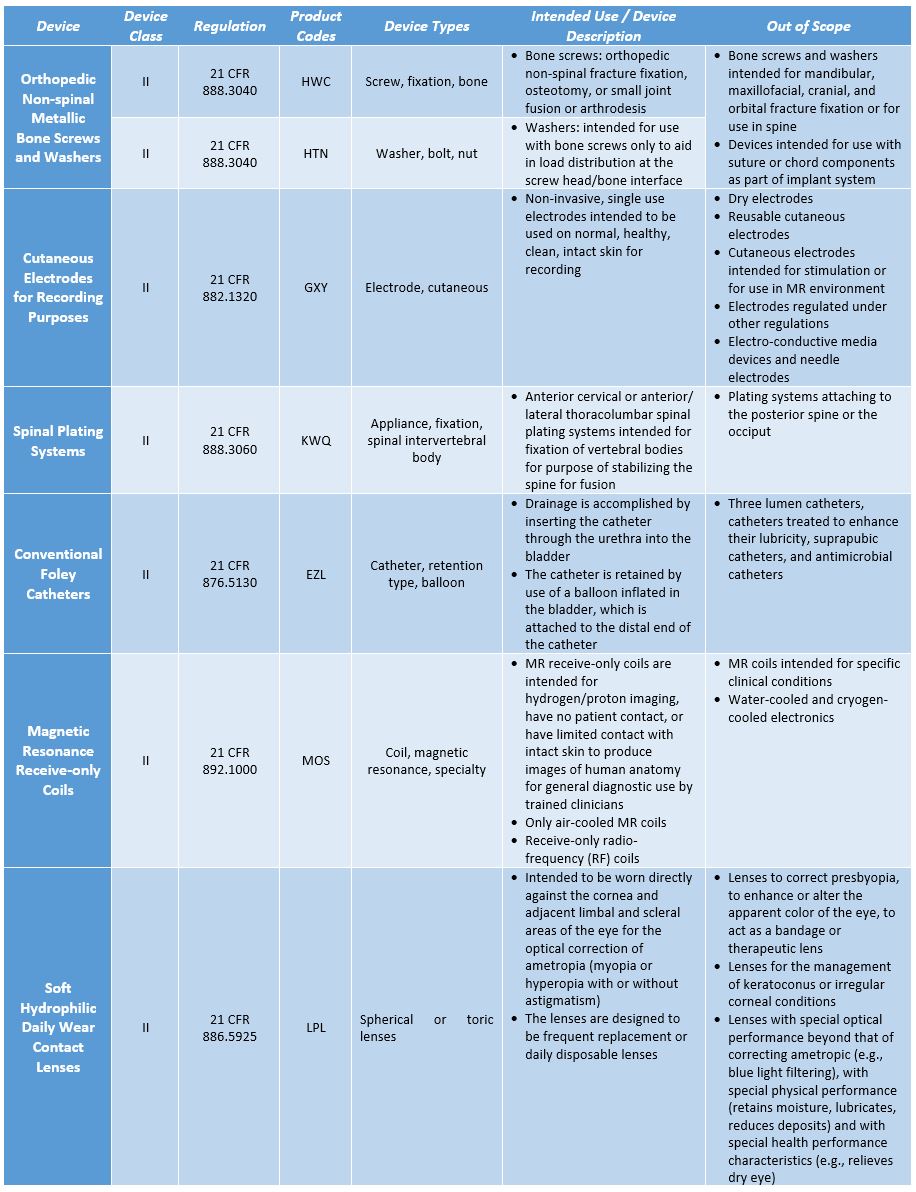
FDA到目前为止已经确定了性能和安全标准和测试方法脊髓电镀系统,骨科脊椎金属骨螺钉和垫圈,只有磁共振接收线圈,皮肤电极为记录目的,和传统的导尿管,最后的指引对每个人都有效。软性(亲水性)日常佩戴隐形眼镜指南草案已被释放,最终的指导意见尚未出台。对于每种类型的设备,指南包括设备的描述,在安全和基于性能的途径的权限范围内包括和排除的设备类型,设备应满足的适用性能标准,以及推荐的测试方法。下表详细列出了这些设备类别的概要。
表1:基于安全性和性能的路径设备类别
在这些指南中定义的性能标准确保新设备在安全和性能方面至少等同于合法上市的设备。安全性和性能可以根据FDA公认的共识标准、FDA指南、特殊控制、科学文献或提交的历史数据进行演示。在选择这一途径时,制造商不应使用FDA不认可的标准中建议的性能标准。有些试验需要完整的试验方案和所有试验报告、试验结果摘要和合格声明足以作为510(k)申请的一部分提交。
当性能标准包含在FDA认可的共识标准中,且制造商使用FDA认可的共识标准中包含的相同测试方法时,在此途径下提交符合性声明就足够了。当FDA在给定器械类别的安全和性能指南中建立了性能标准,且制造商采用了FDA认可标准的测试方法时,应在符合性声明中附上结果摘要。如果FDA在给定设备类别的安全和性能指南中建立了性能标准,并且FDA建议或指定了测试方法,则需要一个测试协议。如果检测方法既不包含在公认的标准中也不被FDA推荐,或者如果制造商使用其内部检测方法作为替代,制造商应提交完整的检测报告。然而,制造商应该注意,FDA不考虑设备特定安全和基于性能的指南中不包括的性能标准。
下表显示了在各种可能的情况下提交时应包含的数据。
表2:各种可能场景下需要的数据。
FDA为安全和基于性能的途径确定的性能标准和方法类型 |
||
性能标准 |
测试方法 |
基于安全性和性能的路径510(k)提交应包括 |
FDA-recognized标准 |
FDA-recognized标准 |
符合标准声明 |
FDA-established |
FDA-recognized标准 |
结果总结及符合性声明 |
FDA-established |
FDA-recommended或指定 |
结果总结和测试方案 |
FDA-established |
没有指定/推荐或替代fda指定使用的方法 |
完整的测试报告 |
提交流程、求职信、拒绝接受(RTA)清单要求、审核流程、电子副本要求和MDUFA费用保持不变与其他类型的上市前通知途径一样像传统的510(k),缩写510(k)和特殊510(k)。FDA审核和决定根据安全和基于性能的途径提交的510(k)的时间是90 FDA天。
为了遵守RTA政策指导,制造商应在同一订单中包括以下列出的部分。如果特定章节不适用于给定的器械类别,制造商可以保留章节标题,并包括“本章节不适用”或“N/ a”的声明,以方便FDA工作人员的审查。说明应该提供为什么某一特定部分不适用于该设备的理由。
表3:要求路段的安全性和基于性能的路径。
|
|
制造商应通过符合标准的声明、结果总结或总结报告(如果在任何相关设备特定指南、测试协议中推荐)和/或证明新设备符合fda识别的性能标准的完整测试报告来证明设备符合标准。制造商应确定谓词并提供商品名称、型号、510(k)提交人/持有人的名称和510(k)编号(如果有的话)。尽管安全性和基于性能的途径不要求制造商将性能规范测试与谓词装置进行比较,但制造商应提供与谓词装置在使用和技术适应症方面的比较。对于510(k)技术文件的其他部分,即建议的标签、灭菌和保质期、生物兼容性、软件、电磁兼容性和电气安全性以及性能测试,数据应按照与典型的510(k)技术文件类似的条款提交,尽管它不是与前述器械的直接比较。
下面是为MR线圈定义的测试方法、性能标准和数据提交要求的示例。
表4:MR线圈的要求根据安全性和基于性能的路径。
测试 |
测试方法 |
提交需求 |
性能标准 |
图像信噪比 |
|
结果总结和符合性声明 |
|
形象整合 |
|
结果总结和符合性声明 |
|
表面加热 |
|
结果总结和符合性声明 |
|
获得的图像质量 |
|
由美国委员会认证或国际同等资格的医师出具的声明 |
|
去耦电路 |
|
解耦机理的电路框图和描述 |
|
免疫力,静电放电 |
|
结果总结和符合性声明 |
|
一般电气/机械安全 |
|
结果总结和符合性声明 |
|
这种安全性和基于性能的途径为设备制造商获得美国市场准入提供了一种经济高效的方式,因为需要检测的样品数量减少了一半。FDA预计将发布符合安全和基于性能途径的附加设备类型的草案和最终指南。
关于作者:
 Jeffrey S. Eberhard就职于Freyr,在医疗器械行业拥有超过15年的经验,在监管事务、质量管理体系(QMS)、风险评估和缓解等方面担任许多关键职位。他曾领导多个美国器械批准项目,包括上市前通知(510(k))。Jeffrey开发了ISO 13485和安全测试程序,并为安全性、有效性和临床研究设计了程序。Jeffrey在无菌医疗设备以及皮肤和口腔护理医疗设备方面拥有丰富的专业知识。
Jeffrey S. Eberhard就职于Freyr,在医疗器械行业拥有超过15年的经验,在监管事务、质量管理体系(QMS)、风险评估和缓解等方面担任许多关键职位。他曾领导多个美国器械批准项目,包括上市前通知(510(k))。Jeffrey开发了ISO 13485和安全测试程序,并为安全性、有效性和临床研究设计了程序。Jeffrey在无菌医疗设备以及皮肤和口腔护理医疗设备方面拥有丰富的专业知识。