英国脱欧最终敲定:2021年1月欧洲医疗器械合规将如何变化?

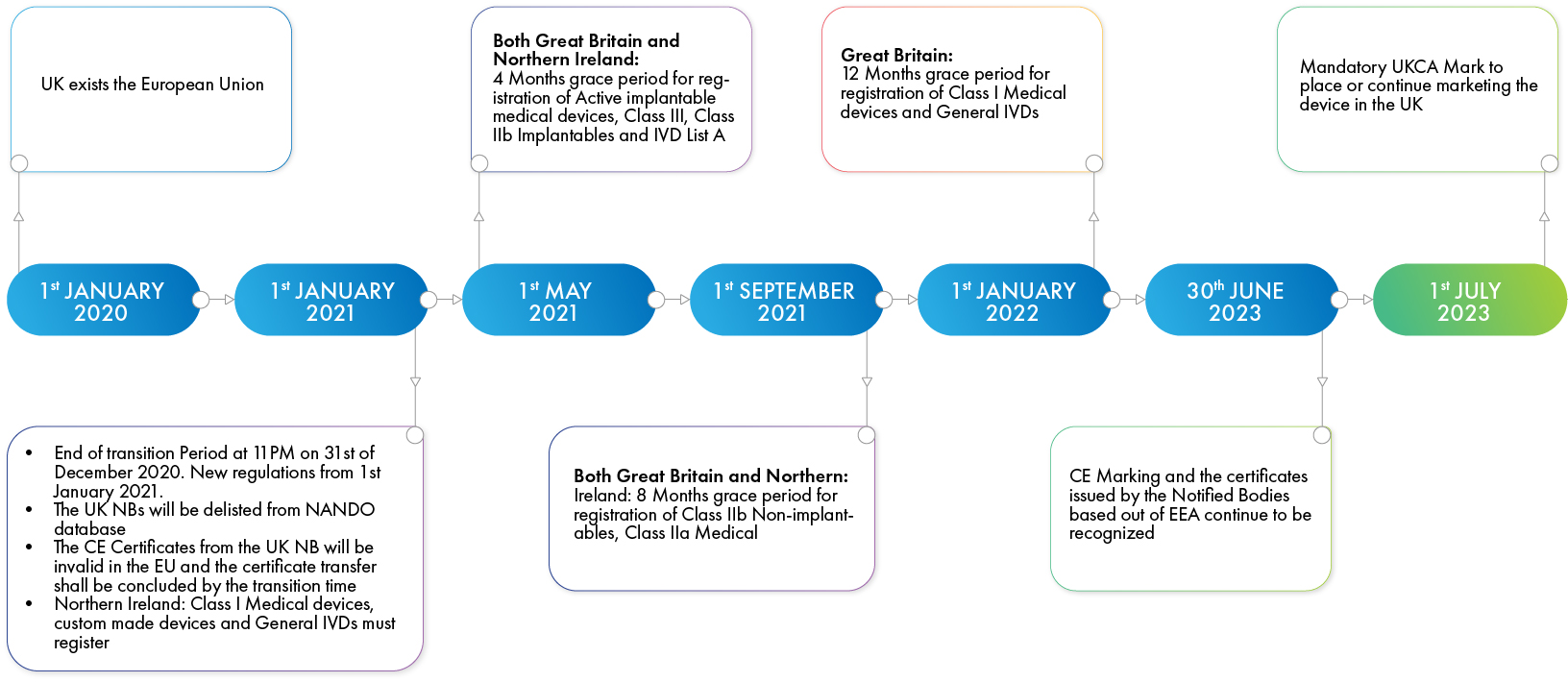
英国于今年早些时候脱离欧盟,为期11个月的过渡期将于2020年12月31日结束。鉴于英国已加入欧盟近46年,双边互动根深蒂固,确保脱欧后英国与欧盟之间无障碍互动的机制至关重要。在英国脱欧过渡期之后,高进口关税、关税和税收将增加设备的成本,使其在英国和欧盟的竞争力下降。负责监管在英国销售的医疗器械的药品和保健产品监管局(MHRA),2020年9月发布了新的指导方针详细说明从2021年1月1日起将如何监管设备,不同设备类别的合规日期不同。新规则将适用于在大不列颠、北爱尔兰和欧盟放置医疗设备。医疗设备和体外诊断(IVD)制造商将需要向MHRA注册医疗设备,确定英国负责人,获得适当的设备认证,并包括适当的设备标记和标签。
制造商的位置、设备的风险分类和感兴趣的市场决定了设备制造商将新设备投放市场和现有设备分销的连续性的监管要求。MHRA的执行权力来源于下面列出的四个主要法规。
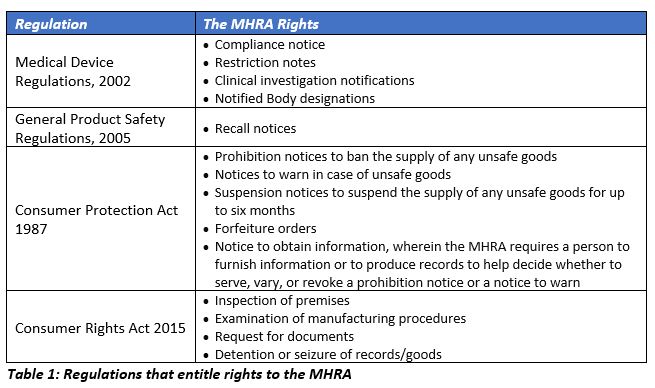
《药品和医疗器械法案》目前正由上议院审查,将在皇家批准后生效。为支持过渡期后的医疗器械行业,更多的法规和指导方针预计将不时出台。根据2002年的《医疗器械条例》(MDR),在2020年12月31日过渡期结束之前,欧盟以及单一市场和关税联盟的现行法律在英国生效。英国不能成为欧盟决策小组的一员。
在英国脱欧之前,英国的设备制造商目前正在遵守90/385 / EEC指令主动植入式医疗装置(EU AIMDD),93/42 / EEC指令(欧盟MDD)和98/79 / EC号指令在IVD医疗设备(EU IVDD)上的规定,以便将设备投放到英国市场。MHRA法规还要求所有I类设备的制造商制造,翻新,或重新贴上制造商名称;包含至少一种医疗器械的任何系统或程序包;还有定制设备和试管制造和/或接受性能评估,以便向卫生监督登记。所有属于任何其他设备类别的其他设备都需要由位于任何欧盟国家(脱欧前称为EU 28,现在为EU 27)的通知机构(NBs)进行合格评估,以便将设备投放市场。
这些地区被分组为大不列颠、北爱尔兰和欧盟27国,以评估英国脱欧对医疗器械行业的影响,并为各利益相关方制定行动计划。的地缘政治场景北爱尔兰的规定则有所不同而不是在英国实施。
MHRA设备注册
从2021年1月1日起,所有设备,无论设备类别,都必须在MHRA注册。根据设备的风险级别,这种强制执行有不同持续时间的宽限期。
- 高风险的第III类和第IIb类植入式装置必须在实施之日起四个月内注册。
- 中等风险的IIa类和其他IIb类设备有8个月的宽限期。
- 低风险的I类设备在英国和北爱尔兰有不同的实施时间表。这些设备需要从2021年1月1日起立即注册,以便在北爱尔兰销售,而在英国销售的设备有12个月的宽限期。英国的这一宽限期不适用于I类、IVD类和定制设备,这些设备甚至在脱欧决定做出之前就需要向MHRA注册。
确定和任命英国负责人
非英国医疗器械制造商需要指定一个英国负责人(UKRP),他必须在MHRA注册。制造商应在英国有一个注册的营业地点,向MHRA注册设备,并对放置在英国的设备承担责任。代表制造商的进口商或分销商可以作为ukrp,并可以与MHRA联系。正如英国MDR 2002所详述的,UKRP的角色和职责是:
- 确保技术文件的可用性和及时更新
- 确保设备合格评定顺利完成
- 确保《合格声明》(DoC)到位
- 掌握有关设备的所有技术信息,并在MHRA要求时提供详细信息和设备样品。如果无法获得样品,UKRP可以与制造商协调,并确保提交样品。
UKRP还将在设备上市后的监督中发挥关键作用,并应与制造商和MHRA合作,实施与投诉和相关安全问题相关的纠正行动和预防行动。
位于英国以外的欧洲授权代表(EAR)将不再被欧盟承认,制造商必须从欧盟27个国家或北爱尔兰指定一个新的EAR。来自英国和欧盟以外国家的制造商需要任命EAR(其角色和职责在MDR和IVDR中定义)在北爱尔兰销售设备。
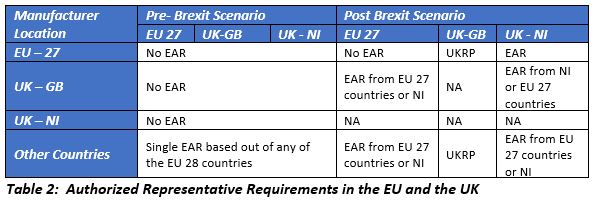
NBs和CE认证的更改
在英国脱欧之前,由于单一市场的概念,由任何欧盟国家的NBs颁发的CE认证在英国和欧盟都得到认可。脱欧后,打算在欧盟27国放置设备或销售设备的制造商需要欧盟27国签发的CE证书。直到2023年6月30日,MHRA继续承认CE标志和由位于欧洲经济区(EEA)的NBs颁发的证书。通过英国NB认证的设备应将其证书转移到欧盟27国以外的NBs,以便继续在欧盟销售。大多数位于英国的国家认证机构与位于欧盟的国家认证机构合作,以促进认证的顺利转移。

对标记和标签的更改
到2023年7月1日,所有在英国销售的设备都需要UKCA标记.在北爱尔兰,UKCA马克是无效的,制造商可以选择CE标志(根据IVDR)或CE英国(NI)标志。
根据MDD、IVDD和AIMDD批准的英国NBs将自动指定为UKCA标志的合格评定机构(cab),自2021年1月1日起生效。从该日期开始,MHRA将开始指定cab。打算在北爱尔兰销售设备的制造商可以从英国或欧盟27的国家统计局获得符合性评估。在爱尔兰,标签上的标记取决于NB的位置。
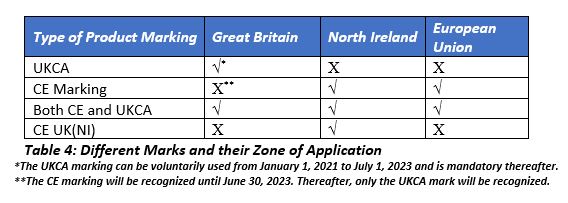
在欧盟27和北爱尔兰放置和销售的设备必须符合欧盟标签要求。脱欧前的市场需要一个CE标志,而脱欧后的市场将有三个标志(一个代表英国,一个代表北爱尔兰,一个代表欧盟)。打算放置在北爱尔兰的设备应该有CE(英国)NI标志(如果使用英国的CAB)或CE标志(如果使用欧盟的NB)。
展望未来:2021年及以后
与英国不同,欧盟MDR和IVDR将分别于2021年5月和2022年5月在北爱尔兰以及其他欧盟27个国家实施。根据产品责任指令85/374/EEC,英国制造的设备的分销商将被视为欧盟的进口商,并将受制于设备的产品责任要求。下表概述了每个地理区域的详细规管要求。
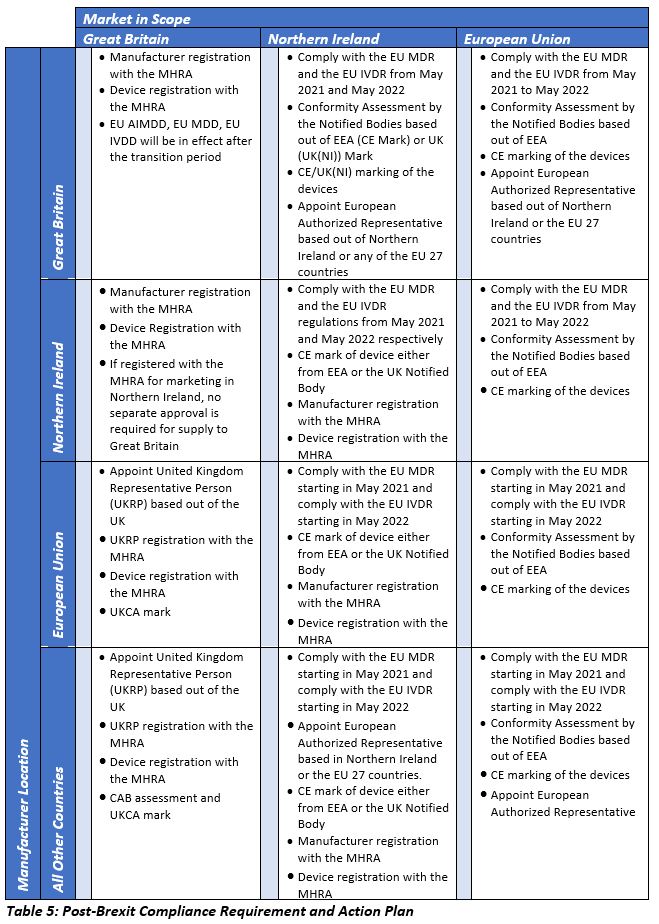
愿意首次在英国推出其设备的非英国设备制造商应遵守欧盟MDD要求,并应开始注册第I类设备或对其他类别的设备进行符合性评估。已经在英国上市的设备制造商可以继续销售他们的I类设备,前提是这些设备已经在MHRA注册。其他设备类别的制造商应与他们当前的国家统计局进行讨论,以便与他们在英国的同行进行任何合作。如果没有,制造商应该找到英国的cab进行重新认证。在上述所有场景中,第一步是确定和任命UKRP,然后进行上述其他活动。
关于作者
 Induja Ratakonda是全球监管服务提供商Freyr的解决方案和售前主管。她拥有医药营销学位,对端到端产品生命周期管理有全面的理解。她处理过从初始开发到监管提交和商业化的复杂多年项目。她对分析全球监管格局和监管动态对制造业的影响有浓厚兴趣。
Induja Ratakonda是全球监管服务提供商Freyr的解决方案和售前主管。她拥有医药营销学位,对端到端产品生命周期管理有全面的理解。她处理过从初始开发到监管提交和商业化的复杂多年项目。她对分析全球监管格局和监管动态对制造业的影响有浓厚兴趣。
 Vardhini S. Kirthivas拥有超过20年的经验,并领导Freyr的战略服务,包括医疗器械卓越中心。她负责全球医疗设备和体外诊断设备的解决方案和项目交付。她领导了涉及软件和人工智能等最新技术的利基医疗设备项目,以及美国、加拿大、欧盟、拉丁美洲和亚太市场的复杂监管提交。在加入Freyr之前,她曾在多家跨国公司工作。
Vardhini S. Kirthivas拥有超过20年的经验,并领导Freyr的战略服务,包括医疗器械卓越中心。她负责全球医疗设备和体外诊断设备的解决方案和项目交付。她领导了涉及软件和人工智能等最新技术的利基医疗设备项目,以及美国、加拿大、欧盟、拉丁美洲和亚太市场的复杂监管提交。在加入Freyr之前,她曾在多家跨国公司工作。